
【题目】(1)在臭氧发生器中装入100mLO2,经反应3O2=2 O3,最后气体体积变为95mL(体积均为标准状况下测定),则反应后混合气体的密度为____________。
(2)将溶质质量分数为a%NaOH溶液蒸发掉m g水后,变成VmL 2a%的NaOH不饱和溶液,则蒸发后的溶液的物质的量浓度是__________。
(3)amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为_______。
(4)现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的质量之比为________(最简整数比)。
(5)标准状况下,密度为0.75g/L 的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为_____________。
【答案】1.5 g·L1 ![]() mol/L b/4a 14:11:8 80% 8.4
mol/L b/4a 14:11:8 80% 8.4
【解析】
(1)反应前氧气的物质的量=![]() =
=![]() mol,故反应前氧气的质量
mol,故反应前氧气的质量![]() mol×32g/mol=
mol×32g/mol=![]() g,根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,故反应后混合气体的密度=
g,根据质量守恒定律可知,反应后混合气体的质量等于反应前氧气的质量,故反应后混合气体的密度=![]() =1.5g/L;
=1.5g/L;
(2)令蒸发后溶液的质量为xg,浓缩蒸发前后溶质的质量不变,则:(x+m)g×a%=x×2a%,解得x=m,NaOH的质量为mg×2a%=2am% g,所以NaOH的物质的量为![]() =
=![]() mol,蒸发后所得溶液体积为VL,所以蒸发后溶液的物质的量浓度为
mol,蒸发后所得溶液体积为VL,所以蒸发后溶液的物质的量浓度为![]() =
=![]() mol/L;
mol/L;
(3)一个硫酸分子中含有四个氧原子,所以含有b个氧原子的硫酸的分子数是![]() ,NA=
,NA=![]() =
=![]() =
=![]() ;
;
(4)CO、CO2、O3三种气体,它们含有的氧原子个数之比为1:2:3,则氧原子的物质的量相同,设都为1mol,则n(CO)=1mol,n(CO2)=![]() mol,n(O3)=
mol,n(O3)=![]() mol,则这三种气体的质量之比为1mol
mol,则这三种气体的质量之比为1mol![]() 28g/mol:
28g/mol:![]() mol
mol![]() 44g/mol:
44g/mol:![]() mol
mol![]() 48g/mol =14:11:8;
48g/mol =14:11:8;
(5)标准状况下,密度为0.75gL-1的NH3与CH4组成的混合气体的平均摩尔质量为:M=0.75gL-1×22.4L/mol=16.8g/mol,设混合气体中NH3、CH4的物质的量分别为x、y,则:![]() =16.8,整理可得:x:y=4:1,相同条件下气体体积之比等于物质的量之比,则混合气体中NH3的体积分数为:
=16.8,整理可得:x:y=4:1,相同条件下气体体积之比等于物质的量之比,则混合气体中NH3的体积分数为:![]() ×100%=80%;混合气体的平均摩尔质量为16.8,该混合气体对氢气的相对密度为
×100%=80%;混合气体的平均摩尔质量为16.8,该混合气体对氢气的相对密度为![]() =8.4。
=8.4。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. C3H8中碳原子都采用的是sp3杂化
B. O2、CO2、N2都是非极性分子
C. 酸性:H2CO3<H3PO4<H2SO4<HClO
D. CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验方案,步骤如图:
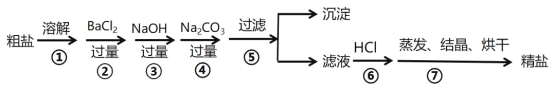
(1)在第①步粗盐溶解操作中要用到玻璃棒搅拌,其目的是_________________;
(2)第②步操作的目的是除去粗盐中的______________;( 填化学式,下同)
(3)第④步操作的目的是除去粗盐中的_____________、______________;,写出相应的离子反应方程式:_______________________;_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是____________________________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是________________________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/(100gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有_______________________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为_________________________________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
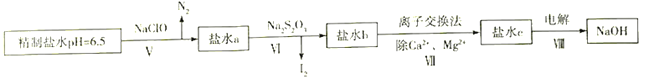
①过程Ⅴ生成N2的离子方程式为__________________________________。
②过程Ⅵ可以通过控制Na2S2O3的量,将IO3-还原为I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为________________________________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配成250 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.050 0 mol·L-1的碘水滴定(发生反应2S2O32-+I2==S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C 具有______性。(填氧化性或还原性)
(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3 CO2↑。该反应的氧化剂是____,当16g 硫参加反应时,转移的电子数为__________。
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。上述反应中,若有10个铝原子参与反应,则转移的电子数为__________个,用“双线桥法”标明反应中电子转移的方向和数目_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学试剂的保存方法不正确的是
A.金属钠保存在煤油中B.氯水保存在棕色瓶中
C.氢氟酸保存在塑料瓶中D.NaOH溶液保存在带玻璃塞的细口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是( )

A. 分解1molFe3O4转移电子数为2NA
B. 根据盖斯定律可知,△H1+△H2=0
C. FeO在CO2转化为C的过程中的作用是催化剂
D. 该工艺是将太阳能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
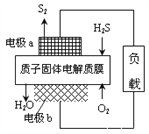
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com