
【题目】CuCl常用作催化剂,石油工业中脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。某课外学习小组用辉铜矿(主要成分为Cu2S,少量的Fe2O3和SiO2)制取氯化亚铜的流程如下:
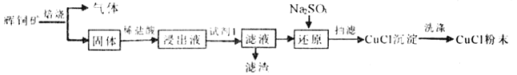
(1)“焙烧”过程发生反应的化学方程式___________;为加快浸取速率常采取的措施___________(写两条)。
(2)加入“试剂1”可调节浸出液的pH,“试剂1”可以是___________;“滤渣”的成分是___________(填化学式)。
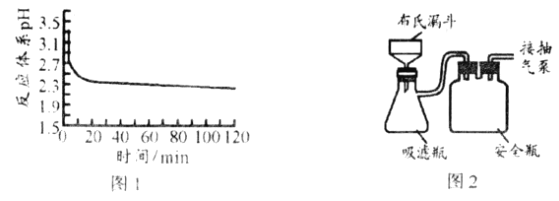
(3)①图1是反应体系pH随时间的变化关系图。写出“还原”制备CuCl的离子方程式___________。
②制备过程中,当n(Na2SO3)与n(CuCl2)比值过大时CuCl产率会变小,其原因可能是_________。
(4)反应完成后经抽滤、洗涤、干燥获得产品。图2为抽滤”装置,抽气泵可使吸滤瓶和安全瓶内压强减小,与普通过滤相比,采用抽滤的优点是___________。
(5)CuCl沉淀的“洗涤”需要经过酸洗、水洗和醇洗。用“去氧水洗后再用“乙醇”洗涤的原因是_______。
(6)取1.0g制备的CuCl粉末样品,先加入足量FeCl3溶液使其完全溶解,再稀释到100mL,从中取出25.00mL,用0.1mol·L-1Ce(SO4)2标准液滴定至终点[Ce(SO4)2被还原为Ce2(SO4)3];三次滴定平消耗标准液的体积为22.00mL。则粉末中CuCl的质量分数为___________。
【答案】Cu2S+2O2![]() 2CuO+SO2 将固体粉碎、升高温度(或适当增大盐酸的浓度等) CuO[或Cu(OH)2,或CuCO3] Fe(OH)3、SiO2 2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+ n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降 加快过滤速度,避免长时间接触空气 快速去除CuCl沉淀表面的水分,防止其潮湿被氧化 88%
2CuO+SO2 将固体粉碎、升高温度(或适当增大盐酸的浓度等) CuO[或Cu(OH)2,或CuCO3] Fe(OH)3、SiO2 2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+ n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降 加快过滤速度,避免长时间接触空气 快速去除CuCl沉淀表面的水分,防止其潮湿被氧化 88%
【解析】
分析题中的流程过程,辉铜矿焙烧,将Cu2S初步转化为CuO和SO2,所得的固体为CuO、Fe2O3、SiO2的混合物,再用稀盐酸对所得固体进行酸浸,得到成分为FeCl3、CuCl2、稀盐酸、SiO2的浸出液。加入试剂1用于调节溶液的pH值,同时将Fe3+转化为Fe(OH)3沉淀而除去,SiO2在这个过程中不参与反应,也以滤渣的形式除去。向滤液中加入Na2SO3,Na2SO3与Cu2+发生氧化还原反应,将Cu2+还原为Cu+,形成CuCl沉淀。将CuCl沉淀洗涤,最终得到CuCl粉末,据此分析。
(1)“焙烧”过程主要是除去可燃性杂质或使原料初步转化,本题为使原料初步转化,发生的化学反应方程式为:Cu2S+2O2![]() 2CuO+SO2;增大原料浸取速率的措施有:将原料粉碎、搅拌、升高温度、增大盐酸的浓度等,故答案为:Cu2S+2O2
2CuO+SO2;增大原料浸取速率的措施有:将原料粉碎、搅拌、升高温度、增大盐酸的浓度等,故答案为:Cu2S+2O2![]() 2CuO+SO2;将固体粉碎、升高温度(或适当增大盐酸的浓度等);
2CuO+SO2;将固体粉碎、升高温度(或适当增大盐酸的浓度等);
(2)由流程图可知,加入试剂1可调节浸出液的pH,也可将Fe3+转化为Fe(OH)3沉淀而除去,同时也不引入新的杂质,故符合条件的为CuO[或Cu(OH)2,或CuCO3];由分析可知,滤渣为:Fe(OH)3、SiO2;答案为:CuO[或Cu(OH)2,或CuCO3];Fe(OH)3、SiO2;
(3)①由分析可知,Na2SO3与Cu2+发生氧化还原反应,将Cu2+还原为Cu+,形成CuCl沉淀。其离子方程式为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;
②Na2SO3为强碱弱酸盐,水解显碱性,n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降;答案为:n(Na2SO3)与n(CuCl2)比值越大,溶液的碱性越强,Cu2+及CuCl的水解程度增大,故CuCl的产率下降;
(4)抽滤的优点为加快过滤速度,避免长时间接触空气;答案为:加快过滤速度,避免长时间接触空气;
(5)乙醇易挥发,进而可快速去除CuCl沉淀表面的水分,防止其潮湿被氧化。故答案为:快速去除CuCl沉淀表面的水分,防止其潮湿被氧化;
(6)由题可知,涉及的离子反应方程式为:CuCl+Fe3+=Cu2++Fe2++Cl-、Ce4++Fe2+=Ce3++Fe3+,可得关系式:CuCl~Ce4+,则CuCl的质量分数=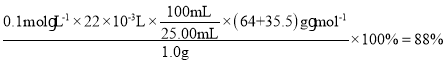 。答案为:88%。
。答案为:88%。


科目:高中化学 来源: 题型:
【题目】为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是( )
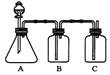
A.HCl、H2CO3、H2SiO3的酸性依次增强
B.A中锥形瓶中生成CO2气体
C.B中装饱和Na2CO3溶液,用于除去A中挥发出的HCl气体
D.C中装Na2SiO3溶液,预期现象是先出现白色沉淀后又逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 Fe 和 Fe2O3 组成的 3.84g 混合物中加入 120mL 某浓度的盐酸,恰好完全反应,生成 672mL H2(标准状况下);向反应后的溶液中滴加几滴 KSCN 溶液,溶液无明显变化。(结果保留三位有效数字)
(1)原混合物中Fe 的质量为____________g.
(2)所用盐酸的物质的量浓度为____________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中所含原子个数由大到小的顺序正确的是( )
①0.3molNH3 ②标准状况下22.4L氯气 ③9mL H2O (4℃) ④0.2mol H3PO4
A. ①④③② B. ④③②① C. ②④③① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种含酰亚胺结构的对苯二胺衍生物的合成路线,其产物(F)可作为一种空腔孔径较大的新型大环芳酰胺的合成原料。
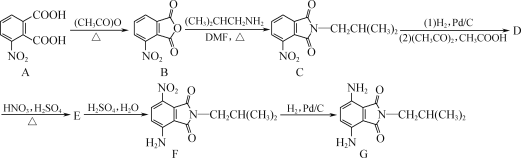
(1)A中官能团的名称为________和________。
(2)F→G的反应类型为________。
(3)D的分子式为C14H16N2O3,写出D的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②含有苯环,且苯环上含有硝基;
③含有三种不同化学环境的氢原子。
(5)写出以甲苯、邻二甲苯,制备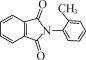 (无机试剂和DMF,(CH3CO)2O及有机溶剂任用,合成路线流程图示例见本题题干)________。
(无机试剂和DMF,(CH3CO)2O及有机溶剂任用,合成路线流程图示例见本题题干)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体a逐滴加到固体b中,下列叙述正确的是
选项 | a | b | c | 现象 | 装置图 |
A | 浓H2SO4 | Cu | 澄清石灰水 | c中溶液变浑浊 |
|
B | 浓盐酸 | KMnO4晶体 | 紫色石蕊溶液 | c中溶液最终呈红色 | |
C | 稀HNO3 | Fe | NaOH溶液 | d中红棕色气体变浅 | |
D | 浓氨水 | 生石灰 | Al2(SO4)3溶液 | c中产生沉淀后溶解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
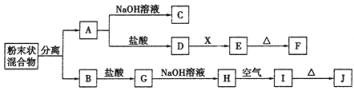
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com