
【题目】电解原理在化学工业中有广泛应用。如图所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
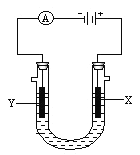
(1)X的电极名称是__________极,发生的电极反应为____________________________;
(2)Y极的电极材料是_________,检验X极产物的方法是_________________________。
(3)某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物,一段时间后又将两极的连接方式纠正过来,发现X极附近出现了白色沉淀,此沉淀是__________(填化学式),其形成原因是_______________________________________,该沉淀在空气中放置,现象是_____________________________________________________。
【答案】 阳 2Cl--2e-=Cl2↑ Fe 用湿润的淀粉碘化钾试纸放在X极附近,若试纸变蓝,说明生成了Cl2 Fe(OH)2 铁作阳极时被氧化为Fe2+,纠正错误后,这一端又变为阴极,2H++2e-=H2↑,生成的OH-与Fe2+结合成Fe(OH)2 先变灰绿色,后变红褐色
【解析】分析:X电极与电源正极相连,作阳极,电极材料是石墨,氯离子放电;Y电极与电源负极相连,作阴极,电极材料是铁,氢离子放电,据此解答。
详解:(1)根据以上分析可知X的电极名称是阳极,氯离子放电,发生的电极反应为2Cl--2e-=Cl2↑;
(2)Y极是阴极,电极材料是铁。X电极产生氯气,氯气具有强氧化性,则检验X极产物的方法是用湿润的淀粉碘化钾试纸放在X极附近,若试纸变蓝,说明生成了Cl2。
(3)某同学在实验时误将两种电极材料接反,则铁电极作阳极,铁失去电子生成亚铁离子,石墨电极作阴极,氢离子放电生成氢气。一段时间后又将两极的连接方式纠正过来,此时铁电极又变为阴极,溶液中的氢离子放电:2H++2e-=H2↑,生成的OH-与Fe2+结合成Fe(OH)2沉淀;氢氧化亚铁不稳定,易被氧化生成氢氧化铁,所以该沉淀在空气中放置的现象是先变灰绿色,后变红褐色。


科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现研究物质A可以通过以下的角度展开。其中A、B、C、D、E中均含甲元素。

请回答:
(1)若甲元素为短周期元素,单质D为黄色固体,A是氧化物。
① 甲元素在元素周期表中的位置是______。
② 氧化物A与少量NaOH溶液反应的离子方程式是______。
(2)若D为金属,A为盐,产物B遇KSCN溶液呈红色。
①下列说法正确的是______(填字母)。
a.单质D可以与足量盐酸、硝酸或硫酸等酸反应生成盐A
b.盐A与NaOH溶液反应时,产物在空气中不稳定,易被O2氧化
c.还原剂Y可选择铜
②若氧化剂X为酸性高锰酸钾溶液,5.6 g 单质D全部转化为产物B时,转移电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“钿”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A. Ts是第七周期第VIIA族元素
B. Ts的同位素原子具有相同的电子数
C. 中子数为176的Ts核素符号是![]()
D. Ts在同族元素中非金属性最弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质]
A、B、C、D为元素周期表中前四周期的四种元素,且原子序数依次增大,C、D同周期,且A、B、C均不在同一周期,其中A与D同主族,且该主族中有三种非金属元素,B为非金属元素且原子最外层有3对成对电子,C元素位于元素周期表第10列。请回答下列问题:
(1)C元素的原子序数为________,基态D原子的简化电子排布式为________。
(2)与A同一周期的所有主族元素中第一电离能小于A的元素共有_______种。
(3) D元素可形成DX3的卤化物,性质和结构与AX3类似(X表示卤素元素),在水溶液中强烈水解,请写出DCl3与水反应的化学方程式:____________。
(4) 如图为D2B3的分子结构图,B杂化方式为____________。

(5) 试比较A、B形成的简单氢化物的熔沸点的高低并解释:________ (简单氢化物用分子式表示)。
(6) 研究晶体结构的最常用方法是________;如图为一种含C和D两种元索的品体的晶胞图,呈六方结构,晶胞参数为底面边长为anm、高为bmm。
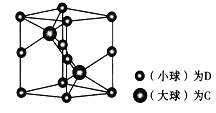
①该晶胞组成物质的化学式为__________。
②已知D和C的相对原子质量分别为M1和M2,若晶体密度为ρg/cm3,NA表示阿伏加德罗常数,用合理表达式表示该晶体的密度为________g/cm3 (列出计算式即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽然很少,但在维持正常生命活动中是不可缺少的。可通过哪一实例得到证明
A. 缺镁时叶片变黄 B. 油菜缺硼时只开花不结果
C. 动物血液中钙盐含量太低会抽搐 D. 缺磷时会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() (立方烷)的分子式均为C8H8,下列说法正确的是
(立方烷)的分子式均为C8H8,下列说法正确的是
A. Z的二氯代物有四种
B. X的同分异构体只有Y和Z
C. X、Y、Z中只有X 的所有原子可能处于同一平面
D. X、Y、 Z均可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)甲醇蒸气完全燃烧的热化学反应方程式为______________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。

(3)H2(g)的燃烧热为________。
(4)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=﹣354.8kJmol﹣1
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566kJmol﹣1
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=________.
(5)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2===2H2O。酸式电池中的电解质是酸,其负极反应可表示为2H2-4e-===4H+,则其正极反应可表示为_____________
(6)根据下式所表示的氧化还原反应设计一个原电池:2Fe3++Cu=2Fe2++Cu2+ .装置采用烧杯和盐桥,请画出原电池的装置图(标出电极材料和电解质溶液)______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是: ;
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
若有6 mol的HCl参加反应,则转移的电子总数为 ;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B: ,D: 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B: ,D: 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com