
【题目】(1)等质量的NO2和N2O4所含分子个数比为_______,氧原子个数比为______,bgNO2和N2O4的混合物中氮元素的质量分数为__________。(保留一位小数)
(2)等温等压下,等体积的O2和O3所含分子个数比为________,质子数之比为________,质量比为________。
【答案】2:1 1:1 30.4% 1:1 2:3 2:3
【解析】
(1)根据n=![]() 、N=n×NA及分子构成计算;
、N=n×NA及分子构成计算;
(2)等温等压下,等体积的气体具有相同的物质的量,结合N=nNA计算出二者的分子数、原子数之比,然后根据m=nM计算出二者的质量之比;NO2和N2O4所含氮元素质量分数相同,可根据化学式NO2计算混合物中氮元素的质量分数。
(1)设NO2和N2O4的质量都为m,根据n=![]() ,NO2和N2O4的物质的量之比为
,NO2和N2O4的物质的量之比为![]() :
:![]() =2:1,根据N=n×NA,则所含分子个数之比为2:1,一个NO2分子中含有2个氧原子,一个N2O4分子中含有4个氧原子,所以其原子个数比为:(2×2):(1×4)=1:1;
=2:1,根据N=n×NA,则所含分子个数之比为2:1,一个NO2分子中含有2个氧原子,一个N2O4分子中含有4个氧原子,所以其原子个数比为:(2×2):(1×4)=1:1;
NO2和N2O4最简式都是NO2,氮元素的质量分数相同:![]() 100%=30.4%,
100%=30.4%,
故答案为:2:1;1:1;30.4%;
(2)同温同压下,气体摩尔体积相等,则等体积O2和O3的物质的量相等,根据N=nNA可以知道O2和O3所含分子个数比为1:1,含有原子数之比为(1×2):(1×3)=2:3;
因为二者的物质的量相等,根据m=nM可以知道,二者的质量之比等于其摩尔质量之比,所以二者质量之比为:32g/mol:48g/mol=2:3,
因此,本题正确答案是:1:1 ;2:3;2:3。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】分别向盛有等物质的量浓度的稀硫酸和氢氧化钠溶液的烧杯中加入足量的铝,反应后放出的气体体积在标准状况下为1︰2,则所取稀硫酸和氢氧化钠溶液的体积比为
A. 1︰2 B. 3︰4 C. 3︰2 D. 6︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2 + O2 ![]() 2SO3(正反应放热)的正、逆反应速率影响的图象如右图所示:
2SO3(正反应放热)的正、逆反应速率影响的图象如右图所示:

(1)加催化剂的图象是___________。
(2)升高温度的图象是___________。
(3)增大容器体积的图象是_______。
(4)增大O2的浓度的图象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为 ( )
A.![]() (a+b) mol B.(a-b) mol C.
(a+b) mol B.(a-b) mol C.![]() (a-b)mol D.(a+b) mol
(a-b)mol D.(a+b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
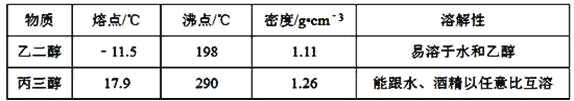
【题目】现有四组分散系:①汽油和水形成的乳浊液、②含有泥沙的食盐水、③溶有溴(Br2)的溴化钾溶液、④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是
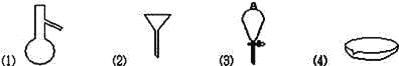
A. ![]() 分液 B.
分液 B. ![]() 过滤 C.
过滤 C. ![]() 萃取 D.
萃取 D. ![]() 蒸馏
蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硝酸的尾气中含有氮氧化物NO、(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。工业上常用Na2CO3溶液吸收法处理NOx。
已知:NO不能与Na2CO3溶液反应
NO+NO2+Na2CO3=2NaNO2+CO2 (I)2NO2+Na2CO3=NaNO2+NaNO3+CO2 (II)
将lmolNOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3-、NO2-两种离子的物质的量随x变化关系如图所示。下列说法正确的是

A. 当NOx被Na2CO3溶液完全吸收时,x的值可能是1.3
B. 用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出) 时,吸收液质量就增加44g,则NOx中的x值为1.875
C. 图中线段a表示NO3-离子的物质的量随x值变化的关系
D. 若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少150g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为“铁链环”结构,图中两环相交部分A、B、C、D表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是
![]()
A. C12+2OH-=Cl-+ClO-+2H2O
B. Cu2++2OH-=Cu(OH)2↓
C. SO42-+Ba2+=BaSO4↓
D. OH-+HCO3-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KNO3和Ba(NO3)2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸、硫酸、硝酸。
(1)试剂a是____________,加入试剂 b所发生反应的离子方程式为______________________。
(2)该方案能否达到实验目的:______________________。(填“能”或“不能”)。若不能, 应如何改进?______________________________________________(若能,此问不用回答)。
(3)若要测定原混合物中 Ba(NO3)2的质量分数,除了要准确称量混合物的质量外至少还要获得的数据是___________的质量。
(4)用所制备的KNO3固体配制0.1mol/KNO3溶液450mL,回答下列问题:
①配制过程中需要用到的玻璃仪器有烧杯、玻璃棒,量筒、胶头滴管、___________;
②需要用托盘天平称量___________gKNO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应框图填空。已知反应①是工业上生产化合物D的反应,反应⑤是实验室检验化合物E的反应。

(1)单质L是________;化合物A是________。
(2)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。它们反应的化学方程式分别是:______________________和_____________________。
(3)E和K、J混合溶液反应的化学方程式为____________________。此反应的发生说明了_____________________________________________________________________。
(4)把K、J混合固体放入少量浓盐酸中,则其反应的现象是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com