
【题目】根据下列反应框图填空。已知反应①是工业上生产化合物D的反应,反应⑤是实验室检验化合物E的反应。

(1)单质L是________;化合物A是________。
(2)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。它们反应的化学方程式分别是:______________________和_____________________。
(3)E和K、J混合溶液反应的化学方程式为____________________。此反应的发生说明了_____________________________________________________________________。
(4)把K、J混合固体放入少量浓盐酸中,则其反应的现象是_________________。
【答案】H2NaCl②④2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑和2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2OCa(ClO)2+CO2 +H2O =CaCO3+2HClO符合强酸制取弱酸的原理,酸性H2CO3>HClO有黄绿色气体生成
2NaOH+H2↑+Cl2↑和2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2OCa(ClO)2+CO2 +H2O =CaCO3+2HClO符合强酸制取弱酸的原理,酸性H2CO3>HClO有黄绿色气体生成
【解析】
根据①是工业上生产化合物D的反应,该反应是C在高温下分解生成D和E的反应;反应⑤是实验室检验化合物E的反应,该反应生成C和B,可以推断:C为碳酸钙、E为二氧化碳、D是氧化钙、G为氢氧化钙、B是水。由题中信息可知,除反应①以外,还有两个用于工业生产的反应,则反应②为电解饱和食盐水的反应、反应④是制备漂白粉的反应,因此可以推断:A为氯化钠、H为氯气、L为氢气、M为氢氧化钠,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,J和K两者必有一种是次氯酸钙。
(1)根据上述分析可知单质L是H2;化合物A是NaCl;
(2)除反应①以外,还有两个用于工业生产的反应,则反应②为电解饱和食盐水的反应、反应④是制备漂白粉的反应,两反应的化学方程式分别为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑、2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O;
2NaOH+H2↑+Cl2↑、2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O;
(3)E是二氧化碳,J和K两者必有一种是次氯酸钙,二氧化碳和次氯酸钙溶液可以发生反应,该反应的化学方程式为:Ca(ClO)2+CO2 +H2O =CaCO3+2HClO,该反应符合强酸制取弱酸的原理,可证明酸性H2CO3>HClO;
(4)次氯酸钙可以和浓盐酸反应生成氯气,故可以观察到有黄绿色气体生成。


科目:高中化学 来源: 题型:
【题目】(1)等质量的NO2和N2O4所含分子个数比为_______,氧原子个数比为______,bgNO2和N2O4的混合物中氮元素的质量分数为__________。(保留一位小数)
(2)等温等压下,等体积的O2和O3所含分子个数比为________,质子数之比为________,质量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应产生氢气的物质的量最多的是
A. 足量的Mg与0.5mol·L-1的稀硝酸200mL
B. 足量的Cu与5mol·L-1的硫酸400mL
C. 足量的Al与0.3mol·L-1的氢氧化钠溶液200mL
D. 足量的Mg与0.5mol·L-1的稀盐酸200mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO3·3H2O2) 在洗涤、纺织、医药等领域有广泛应用。一种制备过碳酸钠的工艺流程如图所示。

(1)碳酸钠水溶液呈碱性的原因是____________(用离子方程式表示),为增强洗涤效果,可采取最简单的措施是________________。
(2)过碳酸钠受热易分解,写出反应的化学方程式:__________________
(3)稳定剂可能是_____(填序号)。
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
(4)结晶时加入食盐的目的是_________,母液中可循环使用的物质是_________(填化学式)。
(5)工业上常以过碳酸钠产品中活性含氧量![]() 来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
来衡量产品优劣,13%以上的为优质品。产品中活性氧含量的测定方法: 称量m g 样品,在250mL 锥形瓶中用100mL 0.5mol/L硫酸完全溶解,立即用c mol/L的高锰酸钾标准溶液进行滴定,至滴定终点,过程中MnO2被还原为Mn2+,进行三次滴定,测得消耗标准溶液平均体积为V1mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗高锰酸钾溶液的体积为V2 mL。该产品活性氧含量为________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如下图所示:
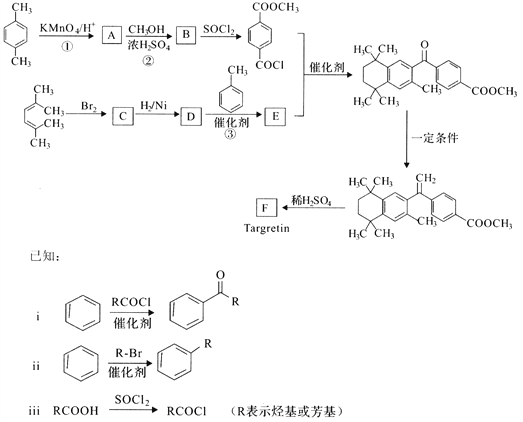
(1)反应①的反应类型是______________。
(2)反应②的化学方程式:__________________________________________。
(3)C的核磁共振氢谱图中有______________个峰。
(4)反应③的化学方程式:__________________________________________。
(5)F的分子式是C24H28O2. F中含有的官能团:__________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或![]() 结构):_______________________________________________________________。
结构):_______________________________________________________________。
a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知:![]() 。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. pH = 8的NaY溶液中,c(Na+) – c(Y-) = 9.9×10-7mol·L-1
B. Na2CO3溶液中,![]()
C. pH相等的①NH4NO3 ②(NH4)2SO4 ③NH4HSO4溶液中,![]() 大小顺序①>②>③
大小顺序①>②>③
D. 10 mL pH=12的NaOH溶液中加入pH = 2的HA溶液至pH = 7,则所得溶液体积一定为20 mL(忽略溶液混合时体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温时,将浓度为m molL﹣1的CH3COOH溶液和n molL﹣1 NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m____ n(填“>”、“<”或“=”,下同);若将pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合,混合溶液的pH______ 7。
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应_________________.
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为_________.
(4)常温时Ksp[Cu(OH)2]=2.2×10﹣20,将Cu(OH)2溶于2.2mol/L CuCl2溶液中形成平衡溶液的pH为____.
(5)物质的量浓度相同的下列溶液①(NH4)2CO3②(NH4)2SO4③NH4HCO3④NH4HSO4⑤NH4Cl⑥NH3H2O,c(NH4+)由小到大的排列顺序是___________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。

(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在。某工厂处理氨氮废水的流程如下:

(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com