
下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl
D.非金属性:F>O>S
科目:高中化学 来源:2016届山东省潍坊市高三上学期期中测试化学试卷(解析版) 题型:选择题
一定条件下,自然界中存在反应:14CuSO4+5FeS2+12H2O==7Cu2S+5FeSO4+12H2SO4。下列说法不正确的是
A.Cu2S既是氧化产物又是还原产物
B.FeS2既作氧化剂,又作还原剂
C.5 mol FeS2发生反应,有21 mol电子转移
D.产物中的SO42-有一部分是氧化产物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.强电解质溶液不一定比弱电解质溶液的导电性强
C.盐酸、氢氧化钠、硫酸钡和氧化铝一定是强电解质
D.强、弱电解质的导电性由溶液中溶质的浓度决定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省滕州市高一上学期期中测试化学试卷(解析版) 题型:计算题
(1)4.9 g H2SO4含 个H2SO4分子,能和 mol NaOH完全反应。
(2)含有相同碳原子数的CO和CO2,其质量比为
(3)在同温同压下,等质量的CO和CO2,其体积之比为
(4)标准状况下有①9.03 x 1023个NH3分子,② 44.8L CH4,③ 85g H2S三种气体,对这三种气体的物质的量从大到小的顺序是
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
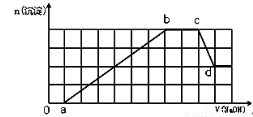
A.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓
B.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.d点溶液中含有的溶质只有NaAlO2
查看答案和解析>>
科目:高中化学 来源:2016届江苏省扬州市高三上学期期中检测化学试卷(解析版) 题型:选择题
下列设计的实验方案能达到实验目的的是
A.制备干燥的NH3:加热浓氨水,将生成的气体通过盛有浓硫酸的洗气瓶
B.提纯含有少量HCl的CO2:将混合气体依次通过盛有饱和碳酸钠溶液、浓硫酸的洗气瓶
C.检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象
D.探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的烧瓶,先后置于冷水和热水中,观察烧瓶中气体颜色的变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省厦门市高一上学期期中测试化学试卷(解析版) 题型:选择题
下列溶液与20mL1 mol·L—1 NaNO3溶液中NO3—物质的量浓度相等的是
A.10 mL 1 mol·L—1 Mg(NO3)2溶液
B.5 mL 0.8 mol·L—1 Al(NO3)3溶液
C.10 mL 2 mol·L—1 AgNO3溶液
D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高一上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
B.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C.碳酸钙与盐酸反应: CO32-+2H+=CO2↑+H2O
D.Ba(OH)2与CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2016届浙江省东阳市高三上学期12月月考化学试卷(解析版) 题型:推断题
Ⅰ.A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
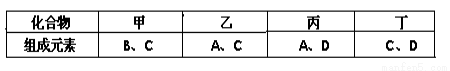
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的电子式为 ,丁物质中阴离子与阳离子的个数之比为 ,写出丁与水反应的离子方程式 。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式 。
(3)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则己与戊按物质的量之比为3:2完全反应后的溶液中各离子浓度的大小关系为 。
Ⅱ.下图是无机物A~N在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。N中只含有两种元素,N可作为工业生产C的原料。

请填写下列空白:
(1)单质G: 。
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是 (填写序号)。
(3)反应⑩的离子方程式是 。
(4)反应④的离子方程式是 。
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾)。同时还生成KNO2和H2O。该反应的化学方程式是: 。
(6)现有1molN参加反应,假设各步反应均完全,生成C的质量为490g,生成G的质量为224g,则反应①的化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com