
����Ŀ��CO�Ǻϳ����ء������ԭ�ϡ�
��1����100 kPa��T K�£����ȶ���������1 mol��������ʱ��Ϊ��������T Kʱ�ı�Ħ�������ʣ��÷��Ŧ�Hm0��ʾ����֪ʯī��CO�ı�ȼ���ȷֱ�Ϊ393.5 kJmol1��283.0 kJmol1 �� ��CO(g)�Ħ�Hm0=��
��2���ϳ����صķ�Ӧ��2NH3(g) + CO(g) == CO(NH2)2(g) + H2(g) ��H =81.0 kJmol1��
��T ��ʱ�������Ϊ2 L�ĺ����ܱ������У���2 molNH3��1 mol CO��Ϸ�����Ӧ��5 minʱ��NH3��ת����Ϊ80%����0��5 min�ڵ�ƽ����Ӧ����Ϊv(CO)=��
����֪��
�¶�/K | 398 | 498 | �� |
ƽ�ⳣ��(K) | 126.5 | K1 | �� |
��K1126.5(���������)�������������
�������ֺ��º��������������ʵ���֮��Ϊ3 mol��NH3��CO�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ��ʾ��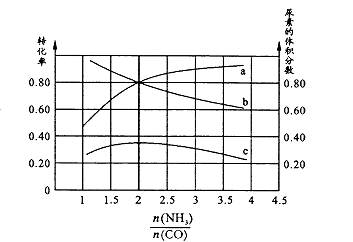
��ͼ��c��ʾƽ����ϵ�����ص������������a��ʾ��ת���ʡ�
�� ![]() =ʱ�����غ������ʱ�����ڸ÷�Ӧ������������Ӧ��������ʹƽ�������ƶ��Ĵ�ʩ��(дһ��)��
=ʱ�����غ������ʱ�����ڸ÷�Ӧ������������Ӧ��������ʹƽ�������ƶ��Ĵ�ʩ��(дһ��)��
��3��ͨ���˹�������ÿɽ�COת����HCOOH��
����֪�����£�Ũ�Ⱦ�Ϊ0.1 molL1��HCOOH��HCOONa�����ҺpH =3.7����HCOOH�ĵ��볣��Ka��ֵΪ(��֪lg2=0.3)��
���õ绯ѧ������HCOOH��ˮ����ɵ���Ⱦ����ԭ���ǵ��CoSO4��ϡ�����HCOOH�����Һ���õ�������Co3+��HCOOH������CO2��
Co3+����HCOOH�����ӷ���ʽΪ��
��������仯�����ǰ��Co2+��Ũ�Ƚ�(���������С�����䡱)��
���𰸡�
��1��?110.5 kJ?mol?1
��2��0.08 mol?L-1��min-1�������ϳ����صķ�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���K��С��CO��2�������ʵ���֮��Ϊ2��1�ټ���NH3��CO
��3��2��10?4��2Co3++HCOOH==CO2��+2Co2++2H+������
���������⣺(1)̼Ԫ�ص��ȶ�������ʯī����CO(g)�Ħ�Hm0ӦΪ��ӦC��s��ʯī��+ ![]() O2��g��=CO��g�����ʱ䣬��ʯ
O2��g��=CO��g�����ʱ䣬��ʯ
ī��CO�ı�ȼ���ȿɵ��Ȼ�ѧ����ʽ:
��C��s��ʯī��+ O2��g��=CO2��g�� ��H1=-393.5 kJmol1
��C��s��ʯī��+ ![]() O2��g��=CO��g����H2=-283.0 kJmol1
O2��g��=CO��g����H2=-283.0 kJmol1
���ݸ�˹���ɣ���һ�ڵ�:
C��s��ʯī��+ ![]() O2��g��=CO��g�� ��Hm0=110.5 kJmol1 ��2����5minʱ��������ת����Ϊ80%����ӳ��NH3Ϊ2mol��80%=1.6mol����CO��Ӧ��0.8mol������c��CO��=0.4 molL-1 �� v(CO)=
O2��g��=CO��g�� ��Hm0=110.5 kJmol1 ��2����5minʱ��������ת����Ϊ80%����ӳ��NH3Ϊ2mol��80%=1.6mol����CO��Ӧ��0.8mol������c��CO��=0.4 molL-1 �� v(CO)= ![]() =0.08 molL-1��min-1����֪�ϳ����صķ�ӦΪ���ȷ�Ӧ�����¶����ߣ�ƽ�������ƶ���K��С�����498Kʱ��ƽ�ⳣ��С��398Kʱ��ƽ�ⳣ������K1��126.5����ͼ��������A���Ű�̼��
=0.08 molL-1��min-1����֪�ϳ����صķ�ӦΪ���ȷ�Ӧ�����¶����ߣ�ƽ�������ƶ���K��С�����498Kʱ��ƽ�ⳣ��С��398Kʱ��ƽ�ⳣ������K1��126.5����ͼ��������A���Ű�̼�� ![]() �������������ƽ���ƶ����ɣ���Ӧ����NH3ռ������ʱ��CO��ת������������ͼ������a��Ӧ����CO��ת���ʡ���ͼ���ֱ�ӿ�������
�������������ƽ���ƶ����ɣ���Ӧ����NH3ռ������ʱ��CO��ת������������ͼ������a��Ӧ����CO��ת���ʡ���ͼ���ֱ�ӿ������� ![]() =2ʱ�����غ�����������¶��ܼӿ췴Ӧ���ʣ���ƽ�������ƶ�����˵��Ŀ�����ƺ��º�����������ѹ���ܼӿ췴Ӧ����Ҳ��ʹƽ�������ƶ�������ѹ���ܱ�֤�����ݡ�����������ֻ�ܼӿ췴Ӧ���ʣ����ܸı�ƽ��״̬������ֻ�ܿ�������Ӧ��Ũ�ȵķ������ȽϺõľ����ʩ��:�����ʵ���֮��Ϊ2:1�ټ���NH3��CO��(3)�ٻ����Һ�д��ڵ���غ�:c��Na+��+ c��H+��= c��HCOO-��+ c��OH-��,��c��HCOO-��= c��Na+��+ c��H+��- c��OH-��=��0.1+10-3.7-10-10.3��mol/L��0.1mpl/L���������غ��c��HCOO-��+ c��HCOOH��=0.2mol/L����c��HCOOH��=0.1mol/L���������ƽ�ⳣ������ʽ��Ka=
=2ʱ�����غ�����������¶��ܼӿ췴Ӧ���ʣ���ƽ�������ƶ�����˵��Ŀ�����ƺ��º�����������ѹ���ܼӿ췴Ӧ����Ҳ��ʹƽ�������ƶ�������ѹ���ܱ�֤�����ݡ�����������ֻ�ܼӿ췴Ӧ���ʣ����ܸı�ƽ��״̬������ֻ�ܿ�������Ӧ��Ũ�ȵķ������ȽϺõľ����ʩ��:�����ʵ���֮��Ϊ2:1�ټ���NH3��CO��(3)�ٻ����Һ�д��ڵ���غ�:c��Na+��+ c��H+��= c��HCOO-��+ c��OH-��,��c��HCOO-��= c��Na+��+ c��H+��- c��OH-��=��0.1+10-3.7-10-10.3��mol/L��0.1mpl/L���������غ��c��HCOO-��+ c��HCOOH��=0.2mol/L����c��HCOOH��=0.1mol/L���������ƽ�ⳣ������ʽ��Ka= ![]() =10-3.7 �� ����֪lg2=0.3����100.3=2�������Ka=10-3.7=2��10-4����������Ϣ:Co3+��HCOOH������CO2 �� ��Co3+��HCOOH��ԭΪCo3+ �� �ɴ˿ɵ�Co3++HCOOH��CO2��+Co2+ �� ��Ӧ������������ϡ���ᣩ�½��У��ɲ�дH+����ƽ�������ӷ���ʽΪ��2Co3++HCOOH==CO2��+2Co2++2H+ �� ���ʱCo2+ת��ΪCo3+,�����Һ�����ɵ�Co3+�ֱ�HCOOH��ԭΪCo2+ �� �����������̼����ǰ��Co2+��Ũ�ȱ��ֲ��䡣
=10-3.7 �� ����֪lg2=0.3����100.3=2�������Ka=10-3.7=2��10-4����������Ϣ:Co3+��HCOOH������CO2 �� ��Co3+��HCOOH��ԭΪCo3+ �� �ɴ˿ɵ�Co3++HCOOH��CO2��+Co2+ �� ��Ӧ������������ϡ���ᣩ�½��У��ɲ�дH+����ƽ�������ӷ���ʽΪ��2Co3++HCOOH==CO2��+2Co2++2H+ �� ���ʱCo2+ת��ΪCo3+,�����Һ�����ɵ�Co3+�ֱ�HCOOH��ԭΪCo2+ �� �����������̼����ǰ��Co2+��Ũ�ȱ��ֲ��䡣
�����㾫����������Ĺؼ��������ⷴӦ�Ⱥ��ʱ�����֪ʶ�������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.����������������Һ��Ӧ��Ba2++SO ![]() �TBaSO4��
�TBaSO4��
B.��������������Һ��Ӧ��Al+OH��+3H2O�TAl��OH�� ![]() +H2��
+H2��
C.�����������Һ��ͨ������SO2 ���壺ClO��+SO2+H2O�THClO+HSO ![]()
D.���ˮ����μ���FeCl3������Һ��Fe3++3H2O ![]() Fe��OH��3�����壩+3H+
Fe��OH��3�����壩+3H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�����У���ѡ�ù���ʵ��������(����)
A. �������B. �����Һ��C. Һ���Һ��D. Һ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3mol A��1mol B�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g��xC��g��+2D��g����2min��÷�Ӧ�ﵽƽ�⣬����0.8mol D�������C��Ũ��Ϊ0.2mol/L�������жϴ�����ǣ� ��
A.x=1
B.2 min��A�ķ�Ӧ����Ϊ0.3 mol/��Lmin��
C.B��ת����Ϊ40%
D.�����������ܶȲ��䣬������÷�Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������г��������᳧���ջ�����ʯ������(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)���Ʊ�����(��ʽ�������ľۺ���)���̷�(FeSO4��7H2O)���������£�
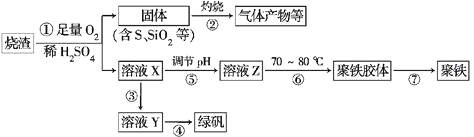
��1�������̢��в���������ͨ��������Һ�У���Һ����ɫ����________(��ѡ�����)��
a��Ʒ����Һ b����ɫʯ����Һ c������KMnO4��Һ d����ˮ
��2�����̢��У�FeS��O2��H2SO4��Ӧ�����ӷ���ʽΪ______________________
��3�����̢��У�������������____________����Ӧ�Ļ�ѧ����ʽΪ_____________________
��μ�����ҺY�д���Fe2+��__________________________________________
��4����ʵ�������ɹ��̢ܵIJ�����____________(���������)����Ҫʹ�þƾ��ơ����żܡ�����ǯ�ȣ�����Ҫ���մ�������___________________________��
��5��ʵ����Ϊ�������õ��ľ�����Ʒ����Ԫ�ص�������������������ʵ�飺���÷�����ƽ��ȡ2.700 g��Ʒ���ڽ���Ʒ�����������������������Ȼ�����Һ���۹��ˡ�ϴ�ӡ�����������ù�������Ϊ3.495 g�����þ�������Ҫ�ɷ�Ϊ[Fe(OH)SO4]n���������Ʒ����Ԫ�ص���������Ϊ________��(���������в�����Ԫ�غ���Ԫ��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱ����3mol A��2mol B����ͨ�����Ϊ2L�Ĺ̶��ܱ������У�������Ӧ��2A��g��+B��g��x C��g����2minʱ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��ʣ��1.5mol B�������C��Ũ��Ϊ0.5mol/L������
��1��x=��
��2��A��ת����Ϊ���٣�
��3��t��ʱ�÷�Ӧ��ƽ�ⳣ������ע��д����Ҫ�ļ�����̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���Fe2+��Mg2+��Cu2+��NH4+��Al3+�е�һ�ֻ��֡�������һ�ֵ���ɫ���岢����ʱ���д̼�������ų��Ͱ�ɫ�������ɣ����뵭��ɫ��������ʵ���(������)�������ij����Ͳ�����������ʵ���(������)�Ĺ�ϵ��ͼ��ʾ�����������������
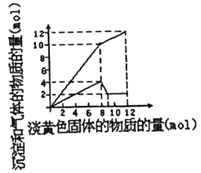
A. ��Һ��һ�����е�������NH4+��Al3+��Mg2+
B. ��Һ�п϶�������Cu2+�����ܺ���Fe2+
C. ���ӵĵ���ɫ������Na2O2
D. ��Һ�е�NH4+��Al3+�����ʵ���Ũ��֮��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ�����кܶ������ʽ���ڵؿ�����Ҫ��NaIO3 ��ʽ���ڣ��ں�ˮ����Ҫ��I-��ʽ���ڣ�����������Cl2֮��������ת����ϵ��
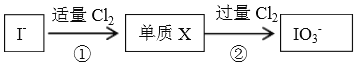
����˵������ȷ����
A. ���з����ķ�Ӧ�ǣ�2I-+Cl2=I2+2Cl-
B. I-�����Cl2�����ķ�Ӧ�ǣ�I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. ���Ϸ�Ӧ�У����������������ԣ��������Ϊ����Ԫ����0�۽���Ϊ-1��
D. ͨ��������Ϣ����Ԥ�⣺���ڼ�����۵�KI��Һ����εμ���ˮ�����ܹ۲쵽��Һ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com