
【题目】下列离子方程式正确的是( )
A.硫酸与氢氧化钡溶液反应:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
B.铝和氢氧化钠溶液反应:Al+OH﹣+3H2O═Al(OH) ![]() +H2↑
+H2↑
C.向次氯酸钠溶液中通入足量SO2 气体:ClO﹣+SO2+H2O═HClO+HSO ![]()
D.向沸水中逐滴加入FeCl3饱和溶液:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】山梨酸是一种常用的酸性防腐剂,其结构简式为CH3CH===CHCH===CH—COOH,下列不属于山梨酸具有的性质的是 ( )
A.能与Br2发生加成反应
B.能与乙醇发生酯化反应
C.易与空气中的O2发生氧化反应
D.能在NaOH溶液作用下发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图分析.下列说法正确的是( ) 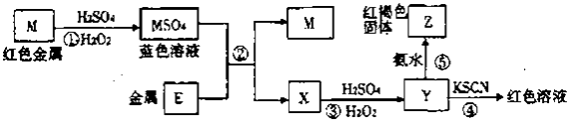
A.E2+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN﹣+E3+=E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A. 铝粉与NaOH溶液反应:Al + 2OH-===AlO![]() + H2↑
+ H2↑
B. SiO2和NaOH溶液反应:SiO2+ 2OH-===SiO![]() + H2O
+ H2O
C. 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH![]() +OH-
+OH-![]() NH3·H2O
NH3·H2O
D. 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.△H>0
B.1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO,CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以提高CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHm0表示。已知石墨和CO的标准燃烧热分别为393.5 kJmol1和283.0 kJmol1 , 则CO(g)的ΔHm0=。
(2)合成尿素的反应:2NH3(g) + CO(g) == CO(NH2)2(g) + H2(g) ΔH =81.0 kJmol1。
①T ℃时,在体积为2 L的恒容密闭容器中,将2 molNH3和1 mol CO混合发生反应,5 min时,NH3的转化率为80%。则0~5 min内的平均反应速率为v(CO)=。
②已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1126.5(填“>”或“<”);其判断理由是。
③若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示: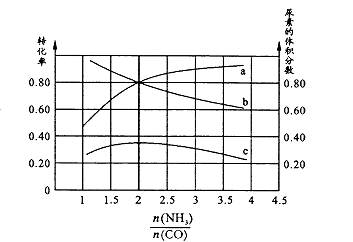
若图中c表示平衡体系中尿素的体积分数,则a表示的转化率。
当 ![]() =时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
=时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
(3)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1 molL1的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka的值为(已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
Co3+氧化HCOOH的离子方程式为;
忽略体积变化,电解前后Co2+的浓度将(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com