
【题目】根据下列框图分析.下列说法正确的是( ) 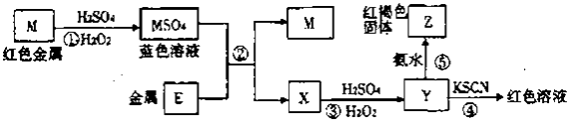
A.E2+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN﹣+E3+=E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
【答案】D
【解析】解:流程分析可知,M为铜,在酸性溶液中被过氧化氢氧化为铜盐溶液CuSO4 , 依据y加入KSCN溶液血红色说明是Fe3+离子,和氨水反应生成红褐色沉淀氢氧化铁;说明X为亚铁离子形成的硫酸亚铁溶液,推断E为Fe;A、依据阳离子氧化性强弱,结合金属活动顺序表分析判断;Fe2+的氧化性比Cu2+的氧化性弱,故A正确;
B、反应①中硫酸只是提供酸性环境,过氧化氢做氧化剂氧化铜,故B错误;
C、反应④的离子方程式可表示为:3SCN﹣+Fe3+=Fe(SCN)3;生成的是血红色溶液,不是沉淀,故C错误;
D、在③反应中若不加稀硫酸,硫酸亚铁被过氧化氢氧化为硫酸铁,在中性溶液中 铁离子会沉淀,可能看到红褐色沉淀,故D正确;
故选D.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】比较小麦和家兔体内的各种化学元素( )
A.种类和含量都相差很大
B.种差相差很大,其中相同元素的含量都大体相同
C.种类和含量都相差不大
D.种类大体相同,其中相同元素的含量大都相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式RO3n-+F2+mOH-=RO4- +aF- +H2O,试推算未知数n=___,a=___,m=____,RO3n- 中元素R的化合价为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.1 L0.6molL﹣1的食盐水中含氯化钠0.6mol
B.0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液的物质的量浓度为0.5molL﹣1
C.标准状况下,44.8L氯化氢气体溶于1L水中所得溶液的物质的量浓度为2molL﹣1
D.20g氢氧化钠溶于水配成物质的量浓度为1molL﹣1的溶液,可得溶液1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则剩余锌粉的质量为
A. 1.0g B. 2.0g C. 2.5g D. 3.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)2HI(g)△H=﹣14.9kJ/mol.某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示.甲中反应达到平衡时,测得c(H2)=0.008mol/L. 下列判断正确的( )
起始浓度 | c(H2)/mol/L | c(I2)/mol/L | c(HI)/mol/L |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]() N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.升高温度同时充入N2
C.加催化剂同时增大压强
D.降低温度同时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.硫酸与氢氧化钡溶液反应:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
B.铝和氢氧化钠溶液反应:Al+OH﹣+3H2O═Al(OH) ![]() +H2↑
+H2↑
C.向次氯酸钠溶液中通入足量SO2 气体:ClO﹣+SO2+H2O═HClO+HSO ![]()
D.向沸水中逐滴加入FeCl3饱和溶液:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com