
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如下:
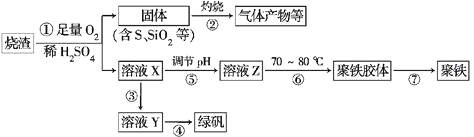
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
如何检验溶液Y中存在Fe2+?__________________________________________
(4)在实验室里,完成过程④的操作是____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的陶瓷仪器有___________________________。
(5)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
【答案】 acd 4FeS+3O2+12H+=4Fe3++6H2O+4S Fe(或铁) Fe2(SO4)3+Fe=3FeSO4 取少量溶液置于洁净试管中,滴加琉氰化钾溶液,无明显现象,再滴加双氧水(或新制氯水),溶液变为血红色,说明溶液中存在Fe2+ 蒸发浓缩,冷却结晶 蒸发皿、玻璃棒 31.1 %
【解析】(1)固体中含有S、SiO2,将其灼烧。其中的S会变为SO2气体,SO2气体有漂白性,能使品红溶液褪色,SO2气体有还原性,能使酸性KMnO4溶液或溴水因发生氧化反应而褪色,但是使紫色石蕊试液变为红色。因此答案选acd;(2)过程①中,根据框图中的各种物质及质量守恒定律和电子守恒、电荷守恒可知:FeS和O2、H2SO4反应的离子方程式为4FeS+3O2+12H+=4Fe3++6H2O+4S;(3)由于发生反应得到的物质中含有Fe3+.,而最后要制取绿矾FeSO4,所以过程③中,要加入还原剂Fe粉,发生反应的化学方程式为:Fe2(SO4)3+Fe=3FeSO4;检验溶液Y中存在Fe2+的方法为:取少量溶液置于洁净试管中,滴加琉氰化钾溶液,无明显现象,再滴加双氧水(或新制氯水),溶液变为血红色,说明溶液中存在Fe2+;(4)在实验室里,完成过程④由溶液得到绿矾,其操作是蒸发浓缩、冷却结晶,需要使用酒精灯、三脚架、坩埚钳等,还需要的陶瓷仪器有,还需要的仪器有蒸发皿、玻璃棒;(5)n(SO42-)=![]() =0.015mol,n(Fe)= n(SO42-)= 0.015mol,所以m(Fe)=0.015mol×56g/mol=0.84g,所以该聚铁样品中铁元素的质量分数为
=0.015mol,n(Fe)= n(SO42-)= 0.015mol,所以m(Fe)=0.015mol×56g/mol=0.84g,所以该聚铁样品中铁元素的质量分数为 ![]() ×100%=31.1%。
×100%=31.1%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO4 ![]() 2CaSO4+2Cl2↑+2H2O,他们设计了如图1所示的制取氯气并验证其性质的实验装置:
2CaSO4+2Cl2↑+2H2O,他们设计了如图1所示的制取氯气并验证其性质的实验装置: 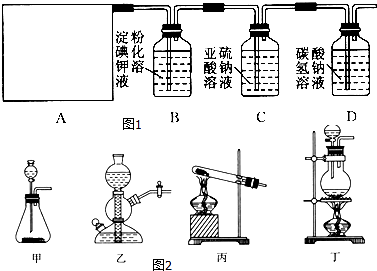
请回答下列问题:
(1)该实验中A部分的装置是图2中的 .
(2)A中发生反应一段时间后,B中的现象是 . B中发生反应的化学方程式为 .
整套实验装置存在的明显缺陷是 .
(3)写出D装置中发生反应的离子方程式 .
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化为Na2SO4(简述实验步骤): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A. 2.25mol/L B. 2mol/L C. 4mol/L D. 0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHm0表示。已知石墨和CO的标准燃烧热分别为393.5 kJmol1和283.0 kJmol1 , 则CO(g)的ΔHm0=。
(2)合成尿素的反应:2NH3(g) + CO(g) == CO(NH2)2(g) + H2(g) ΔH =81.0 kJmol1。
①T ℃时,在体积为2 L的恒容密闭容器中,将2 molNH3和1 mol CO混合发生反应,5 min时,NH3的转化率为80%。则0~5 min内的平均反应速率为v(CO)=。
②已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1126.5(填“>”或“<”);其判断理由是。
③若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示: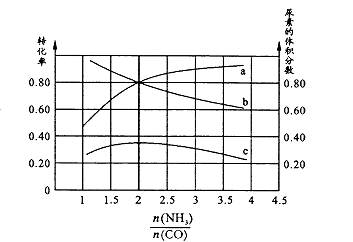
若图中c表示平衡体系中尿素的体积分数,则a表示的转化率。
当 ![]() =时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
=时,尿素含量最大;此时,对于该反应既能增大正反应速率又能使平衡正向移动的措施是(写一种)。
(3)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1 molL1的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka的值为(已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
Co3+氧化HCOOH的离子方程式为;
忽略体积变化,电解前后Co2+的浓度将(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Li、Na、K、Rb的叙述不正确的是
A.碱性:KOH>LiOHB.原子半径:r(K)>r(Na)
C.它们的单质燃烧时火焰均呈紫色D.实验室中少量的钠可保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
以芳香烃A为原料合成有机物F和I的合成路线如下: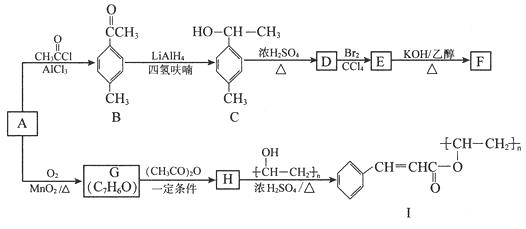
(1)A的分子式为 , C中官能团名称为。
(2)D分子中最多有个原子共平面。
(3)E生成F的反应类型为 , G的结构简式为。
(4)由H生成I的化学方程式为。
(5)符合下列条件的B的同分异构体有种(不考虑立体异构),其中核磁共振氢谱为4组峰且面积比为6∶2∶1∶1的是
(写出其中一种的结构简式)。
①属于芳香化合物 ②能发生银镜反应
(6)已知RCOOH ![]() RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备 ![]() 的合成路线。
的合成路线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是()
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗不便于添加液体
D.尽量避免HCl挥发到空气中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在常温下一定能大量共存的是( )
A.pH=0的无色溶液中:Cl﹣、Na+、SO ![]() 、Fe2+
、Fe2+
B.在 ![]() ?=1012的溶液中:NH
?=1012的溶液中:NH ![]() 、NO
、NO ![]() 、K+、Cl﹣
、K+、Cl﹣
C.加入铝粉能放出H2的溶液中:Mg2+、NH ![]() 、NO
、NO ![]() 、Cl﹣
、Cl﹣
D.含有大量Fe3+的溶液中:Al3+、SCN﹣、Br﹣、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com