
【题目】利用下图所示装置进行下列实验,能得出相应实验结论的是( )
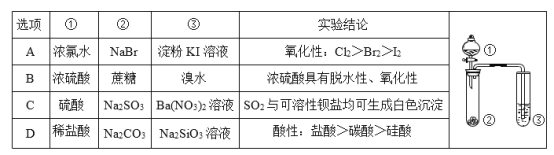
A.AB.BC.CD.D
【答案】B
【解析】
A.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性。浓氯水能挥发出氯气,该实验中氯气易参与试管中的反应,故无法证明溴和碘的氧化性的强弱关系,A得不到相应结论;
B.浓硫酸使蔗糖变黑,证明浓硫酸有脱水性;然后有气体生成,该气体能使溴水褪色,证明有二氧化硫生成,说明浓硫酸有强氧化性,可以被C还原为二氧化硫,故B可以得出相应的结论;
C.SO2溶解在试管中使溶液显酸性,与Ba(NO3)2溶液发生氧化还原反应得到SO42-,所以生成硫酸钡白色沉淀,故C得不到相应的结论;
D.盐酸有挥发性,挥发出的盐酸也会与Na2SiO3溶液反应得到硅酸沉淀。因此不能证明酸性:碳酸>硅酸,D得不到相应的结论。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】扑炎痛是一种新型解热镇痛抗炎药,其结构简式如图: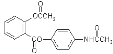 ,下列关于扑炎痛的叙述错误的是( )
,下列关于扑炎痛的叙述错误的是( )
A. 该物质的相对分子质量为313B. 该物质的水解产物有氨基酸
C. 该物质的水解产物之一与甲酸甲酯互为同分异构体D. 该物质的核磁共振氢谱上共有9个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)中国的瓷器驰名世界,制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为_;
(2)在25℃、101kPa时,2molH2在O2中完全燃烧,生成2mol液态水,放出571.6kJ热量,用燃烧热表示H2燃烧的热化学方程式为:__;
(3)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的,这一过程中发生反应的化学方程式为:_____________;
(4)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与浓盐酸反应生产ClO2的,反应过程中同时会生成氯气。写出该反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用 CuO 与 NH3 反应,研究 NH3 的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
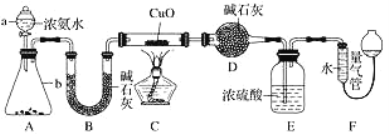
(1)仪器a的名称为_____;仪器b中可选择的试剂为________(填名称)。
(2)实验室中,利用装置A,还可制取的无色气体是______ (填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式____________。
(4)E装置中浓硫酸的作用________。
(5)读取气体体积前,应对装置F进行的操作:__________。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图,Y的氧化物随意排放易形成酸雨,下列说法不正确的是:
![]()
A.化合物XZ3分子中只存在极性共价键
B.X、Y、Z三种元素分别形成的含氧酸不一定都是强酸
C.因为非金属性Z>Y,所以水溶液中酸性HZ>H2Y
D.X的最高价氧化物对应的水化物和X的简单氢化物能形成盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是

A. M的分子式为C18H20O2
B. M可与NaOH溶液或NaHCO3溶液均能反应
C. 1 mol M最多能与7 mol H2发生加成反应
D. 1 mol M与饱和溴水混合,最多消耗5 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量可以衡量国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH ③已知乳酸E的结构简式为
2CH3COOH ③已知乳酸E的结构简式为![]() ,现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
,现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
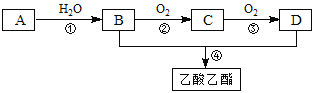
回答下列问题:
(1)A为______________(填结构简式) C为________________(填名称)
(2)E分子中所含有的官能团是_______________、________________(填名称)
(3)写出第②和④步反应的化学方程式:
②的方程式______________________________________________;反应类型_________
④的方程式______________________________________________;反应类型__________
(4)写出E和足量钠反应的方程式__________________________________________。
(5)写出两个E分子在一定条件下反应生成六元环状酯的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2的元素共有___种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______。
(2)已知:2UO2+5NH4HF2 150℃ 2UF4·NH4F+3NH3↑+4H2O↑ HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__________ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______种。
(3)已知:3(NH4)4[UO2(CO3)3] 800℃ 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①物质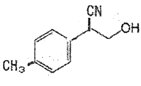 中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
②分解所得的气态化合物的分子键角由小到大的顺序为_________(填化学式)
(4)下列排列方式中,通常条件下Cu的晶体的堆积方式是_________(填序号)。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
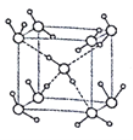
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H-O距离为apm,阿伏加德罗常数的值为NA,则该冰Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com