
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2的元素共有___种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______。
(2)已知:2UO2+5NH4HF2 150℃ 2UF4·NH4F+3NH3↑+4H2O↑ HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__________ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______种。
(3)已知:3(NH4)4[UO2(CO3)3] 800℃ 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①物质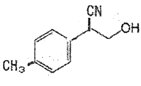 中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
②分解所得的气态化合物的分子键角由小到大的顺序为_________(填化学式)
(4)下列排列方式中,通常条件下Cu的晶体的堆积方式是_________(填序号)。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
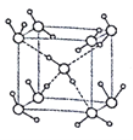
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H-O距离为apm,阿伏加德罗常数的值为NA,则该冰Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
【答案】4 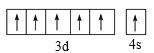 BCD 3 3:2 H2O<NH3<CO2 A
BCD 3 3:2 H2O<NH3<CO2 A 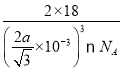
【解析】
(1)与钙同周期基态原子的未成对电子数为2 的元素有:Ti,Ni,Ge,Se,Mg的原子序数为12,则原子序数为镁元素的二倍的元素为Cr,Cr处于周期表中第四周期第ⅥB族;
(2)①NH4HF2中含有离子键,共价键,配位键;
②与氧同周期,且第一电离能比氧大的元素有N、F、Ne;
(3)①CO32-中C的杂化方式为sp2,分子中苯环C为sp2杂化,-CN中C为sp杂化,-CH3与-CH2-中与-CH中C为sp3杂化,据此计算;
②分解所得的气态化合物有H2O,NH3,CO2,H2O为V形,NH3为三角锥形,CO2为直线形,H2O中有两对孤电子对,NH3中1对孤电子对,孤电子对与键合电子对斥力大于键合电子对与键合电子对间斥力;
(4)Cu是面心立方最密堆积,它的堆积方式为ABCABCABC;
(5)根据ρ=![]() 计算密度。
计算密度。
(1)与钙同周期基态原子的未成对电子数为2 的元素有:Ti、Ni、Ge、Se,共有4种;Mg的原子序数为12,则原子序数为镁元素的二倍的元素为Cr,Cr处于周期表中第四周期第ⅥB族,其价电子排布式为3d54s1,则价电子排布图为: ;
;
(2)①NH4HF2中含有离子键,共价键,配位键,所以合理选项是BCD;
②与氧同周期,且第一电离能比氧大的元素有N、F、Ne,共有3种元素
(3)①CO32-中C的杂化方式为sp2,分子中苯环C为sp2杂化,-CN中C为sp杂化,-CH3与-CH2-中与-CH3中C为sp3杂化,所以分子中sp2杂化的C原子有6个,sp杂化C原子有1个,sp3杂化的C原子有3个,则与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为6:4=3:2;
②分解所得的气态化合物有H2O,NH3,CO2,H2O为V形,NH3为三角锥形,CO2为直线形,H2O中有两对孤电子对,NH3中1对孤电子对,孤电子对与键合电子对斥力大于键合电子对与键合电子对间斥力,所以键角大小为:H2O<NH3<CO2;
(4)Cu是面心立方最密堆积,它的堆积方式为ABCABCABC;
(5)根据图示结构分析,一个晶胞中含有H2O的数目为8×![]() +1=2个,不妨取1mol这样的晶胞,即有NA个这样的晶胞,1mol晶胞的质量为m=2×18g=36g,一个晶胞的体积为V=L3cm3,根据几何关系,每个水分子与周围4个水分子以氢键结合,则晶胞边长(L)与O-H…O距离间存在关系为:L=
+1=2个,不妨取1mol这样的晶胞,即有NA个这样的晶胞,1mol晶胞的质量为m=2×18g=36g,一个晶胞的体积为V=L3cm3,根据几何关系,每个水分子与周围4个水分子以氢键结合,则晶胞边长(L)与O-H…O距离间存在关系为:L=![]() ,所以一个晶胞体积为V=L3pm3=(
,所以一个晶胞体积为V=L3pm3=(![]() ×10-10)3cm3,则晶体密度为ρ=
×10-10)3cm3,则晶体密度为ρ=![]() =
=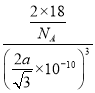 g/cm3=
g/cm3=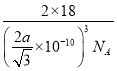 g/cm3。
g/cm3。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.1 mol·L-1
B. 通入CO2的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3) = 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以进行实验并能达到实验目的的是
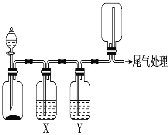
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 用CaO与浓氨水制取并收集纯净干燥的NH3 | NaOH溶液 | 碱石灰 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,是基态原子电子排布图的是________(填标号),能量(由低到高)排在第二位的是__________(填标号)。
A.![]()
B.![]()
C.![]()
D.![]()
(2)Li+与H-具有相同的电子构型,r(H-)______r(Li+)(填“<”或“>”),LiAlH4中,不存在_________(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(3)Li2O是离子晶体,其晶格能可通过图(a)的Bormi﹣Haber循环计算得到。

可知,Li2O晶格能为________kJmol﹣1,Li原子的第一电离能为_______kJmol﹣1,O=O键键能为________kJmol﹣1。
(4)Li2O晶胞如图所示。1个晶胞中有Li+______个,O2-_______个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物H是一种医药中间体,常用于防晒霜中紫外线的吸收剂。实验室由化合物A和E制备H的一种合成路线如下图:
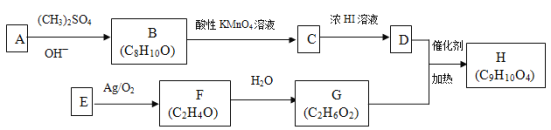
已知①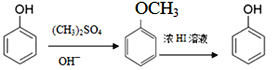
②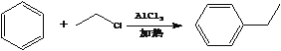
回答下列问题:
(1)经测定E的相对分子质量为28,常用来测定有机物相对分子质量的仪器为_______。F中只有一种化学环境的氢原子,其结构简式为_________________。
(2)(CH3)2SO4是一种酯,其名称为_________________。
(3)A能与Na2CO3溶液及浓溴水反应,且1molA最多可与2molBr2反应。核磁共振氢谱表明A的苯环上有四种不同化学环境的氢原子。A的结构简式为______________。C中含氧官能团的名称为_________。
(4)D+G→H的化学方程式为__________________。
(5)C的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①遇FeCl3溶液发生显色反应
②能发生水解反应
(6)参照上述合成路线,设计一条由![]() 和(CH3)3CCl为起始原料制备
和(CH3)3CCl为起始原料制备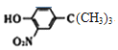 的合成路线(其他试剂任选); ________________________________________。
的合成路线(其他试剂任选); ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置及原理正确的是( )
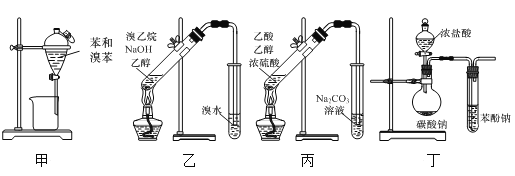
A.用图甲装置分离苯和溴苯的混合物
B.用图乙装置检验溴乙烷的消去产物
C.用图丙装置制取并收集乙酸乙酯
D.用图丁装置验证酸性:碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/(kJ/mol) | 351.5 | 463 | 393 | 293 |
则该反应的ΔH=________kJ/mol。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①下列说法不能判断该反应达到化学平衡状态的是________。
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
③某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式__________________。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7/span> |
HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应的平衡常数K=_____________。
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是中学常见的强氧化剂,用固体碱熔氧化法制备KMnO4的流程和反应原理如图:

反应原理:
反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
请回答:
(1)下列操作或描述正确的是___
A.反应Ⅰ在瓷坩埚中进行,并用玻璃棒搅拌
B.步骤⑥中可用HCl气体代替CO2气体
C.可用玻璃棒沾取溶液于滤纸上,若滤纸上只有紫红色而无绿色痕迹,则反应Ⅱ完全
D.步骤⑦中蒸发浓缩至溶液表面有晶膜出现再冷却结晶:烘干时温度不能过高
(2)___(填“能”或“不能”)通入过量CO2气体,理由是___(用化学方程式和简要文字说明)。
(3)步骤⑦中应用玻璃纤维代替滤纸进行抽滤操作,理由是___。
草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.6000g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5025g已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。
记录实验数据如表
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
已知:MnO4﹣+C2O42﹣+H+→Mn2++CO2↑+H2O(未配平)
则KMnO4的纯度为___(保留四位有效数字);若滴定后俯视读数,结果将___(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com