
����Ŀ��Li������Ĺ������������Li��Ϊ�������ϵĵ�ؾ���С���ᡢ�����ܶȴ���������ܣ��õ��㷺Ӧ�á��ش��������⣺
(1)����Liԭ�ӵ����Ų�ͼ��ʾ��״̬�У��ǻ�̬ԭ�ӵ����Ų�ͼ����________(����)������(�ɵ͵���)���ڵڶ�λ����__________(����)��
A��![]()
B��![]()
C��![]()
D��![]()
(2)Li+��H-������ͬ�ĵ��ӹ��ͣ�r(H-)______r(Li+)(����������������)��LiAlH4�У�������_________(����)��
A�����Ӽ� B������ C������ D�����
(3)Li2O�����Ӿ��壬�侧���ܿ�ͨ��ͼ(a)��Bormi��Haberѭ������õ���

��֪��Li2O������Ϊ________kJmol��1��Liԭ�ӵĵ�һ������Ϊ_______kJmol��1��O=O������Ϊ________kJmol��1��
(4)Li2O������ͼ��ʾ��1����������Li+______����O2-_______����

���𰸡�D A > CD 2908 520 498 8 4
��������
��1��������͵�״̬ӦΪ��̬����Ϊ1s22p1������Խ�ߵ�״̬Ӧ�������ϸ��ܼ��и���ĵ��ӣ���������(�ɵ͵���)���ڵڶ�λ����A���ʴ�Ϊ��D��A��
��2��Li+�ĺ����������H-��ͬ���ڵ��ӽṹ��ͬ������£��˵����Խ��������Խǿ�����Ӱ뾶ԽС������r(H-)��r(Li+)��LiAlH4Ϊ���ӻ��������Li+��AlH4-���ʴ������Ӽ���AlH4-��Al��H��������ϣ�����LiAlH4�в����ڵ���������������ʴ�Ϊ��>��CD��
��3��������Ϊ����̬�����γ�1mol����ų����������ʾ�����Ϊ2908kJmol��1����ͼ��2Li(����)![]() 2Li(g)
2Li(g)![]() 2Li+(g)���̣�������Ϊ1mol����̬ԭ�ӱ�Ϊ+1�������ӵ������������һ������Ϊ
2Li+(g)���̣�������Ϊ1mol����̬ԭ�ӱ�Ϊ+1�������ӵ������������һ������Ϊ![]() kJmol��1=520kJmol��1����ͼ��
kJmol��1=520kJmol��1����ͼ��![]() O2(g)
O2(g)![]() 2O(g)Ϊ
2O(g)Ϊ![]() molO=O�ļ��ܣ���O=O������Ϊ249kJmol��1��2=498kJmol��1���ʴ�Ϊ��2908��520��498��
molO=O�ļ��ܣ���O=O������Ϊ249kJmol��1��2=498kJmol��1���ʴ�Ϊ��2908��520��498��
��4���ɾ����Ľṹ��֪��Liȫ���ھ������ڲ�������1�������к���8��Li+��O�ֱ�λ�ھ����Ķ�������ģ����ݾ�����ԭ�ӵġ���̯�����ɼ���1��������O2-�ĸ���Ϊ��8��![]() +6��
+6��![]() =4���ʴ�Ϊ��8��4��
=4���ʴ�Ϊ��8��4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�������� CuO �� NH3 ��Ӧ���о� NH3 ��ij�����ʲ��ⶨ����ɣ����������ʵ��װ��(�г�װ��δ����)����ʵ�顣��ش��������⣺
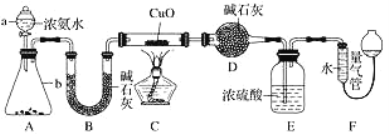
(1)����a������Ϊ_____������b�п�ѡ����Լ�Ϊ________(������)��
(2)ʵ�����У�����װ��A��������ȡ����ɫ������______ (����ĸ)��
A��Cl2 B��O2 C��CO2 D��NO2
(3)ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�����壬��������֤��NH3����______�ԣ�д����Ӧ�Ļ�ѧ����ʽ____________��
(4)Eװ����Ũ���������________��
(5)��ȡ�������ǰ��Ӧ��װ��F���еIJ�����__________��
(6)ʵ����ϣ�����ø����D����mg��װ��F�����������ΪnL(������ɱ�״��)�������е������ԭ�Ӹ�����Ϊ___________(�ú�m��n��ĸ�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ��ķ�Ӧ���ڸ��¡���ѹ���д������ڵ������£��������͵���ֱ�ӻ�����ȡ��3H2��N2![]() 2NH3������һ������Ӧ���ȵĿ��淴Ӧ�������Ӧ���ܱ������н��У������й�˵���д������
2NH3������һ������Ӧ���ȵĿ��淴Ӧ�������Ӧ���ܱ������н��У������й�˵���д������
A.Ϊ�����H2��ת���ʡ�Ӧ�ʵ����N2��Ũ��
B.�ﵽƽ��ʱ��c(NH3)һ����c(H2)������֮��
C.ʹ�ô�����Ϊ�˼ӿ췴Ӧ���ʣ��������Ч��
D.�ﵽƽ��ʱ�������ֽ������ǵ����������ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��Jʮ������֮���ת����ϵ��ͼ��ʾ�����в����������Ӧ��������ȥ��AΪ���Σ����¡���ѹ�£�B��C��D��E��G��H��I��Ϊ���壬����D��G��HΪ���ʣ�HΪ����ɫ���壬Iͨ��Ϊ����ɫ���壬I����Է���������E�Ĵ�16��F�ڳ�������һ����ɫҺ�壻G����H��ȼ�գ�������ɫ���棬����C������ˮ��J��һԪ����ǿ�ᡣ
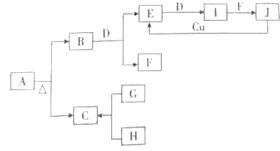
�ش��������⣺
(1)A�Ļ�ѧʽΪ_________��
(2)һ�������£�B��D��Ӧ����E��F�Ļ�ѧ����ʽΪ_____________��
(3)J�ͽ���Cu��Ӧ����E�Ļ�ѧ����ʽΪ_______��
(4)H��ʯ���鷴Ӧ�Ļ�ѧ����ʽΪ___________��
(5)��I��F�ķ�Ӧ�У��������ͻ�ԭ��������֮��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪HX�����Ա�HY���������ʵ���Ũ�Ⱦ�Ϊ0.1molL��1��NaX��NaY�����Һ�У�����������ȷ����( )
A. c(OH��)��c(HX)��c(HY)��c(H+)
B. c(OH��)��c(X��)��c(Y��)��c(H+)
C. c(OH��)��c(Y��)��c(X��)��c(H+)
D. c(OH��)��c(HY)��c(HX)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�ӷ�Ӧ�ѵ�ԭ�ϣ������˵Ļ�������UF4��UO2��(NH4)4[UO2(CO3)3]�ȡ��ش��������⣺
(1)UF4��Mg��Ca��ԭ�ɵý����ˡ����ͬ���ڻ�̬ԭ�ӵ�δ�ɶԵ�����Ϊ2��Ԫ�ع���___�֣�ԭ������ΪþԪ�صĶ�����Ԫ�صĻ�̬ԭ�Ӽ۵����Ų�ͼΪ_______��
(2)��֪��2UO2+5NH4HF2 150�� 2UF4��NH4F+3NH3��+4H2O�� HF2-�ĽṹΪ[F-H��F]-
��NH4HF2�к��еĻ�ѧ����__________ (��ѡ����ĸ)��
A.��� B.��λ�� C.���ۼ� D.���Ӽ� E.������
������ͬ���ڣ��ҵ�һ�����ܱ������Ԫ����______�֡�
(3)��֪��3(NH4)4[UO2(CO3)3] 800�� 3UO2+10NH3��+9CO2��+N2��+9H2O��
������ ����CO32-��̼ԭ���ӻ�������ͬ�Ͳ�ͬ��̼ԭ�ӵĸ�����Ϊ______��
����CO32-��̼ԭ���ӻ�������ͬ�Ͳ�ͬ��̼ԭ�ӵĸ�����Ϊ______��
�ڷֽ����õ���̬������ķ��Ӽ�����С�����˳��Ϊ_________(�ѧʽ)
(4)�������з�ʽ�У�ͨ��������Cu�ľ���Ķѻ���ʽ��_________(�����)��
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
(5)ˮ�ڲ�ͬ���¶Ⱥ�ѹ�������¿��γ�11�ֲ�ͬ�ṹ�ľ��壬�ܶȴӱ�ˮ���0.92g/cm3��ԼΪˮ��1.5������������������֪����һ�ּ��Ӷѻ����ṹ�������Ļ�������б�- ���ľ���ṹΪһ����ͼ��ʾ������������ÿ��ˮ��������Χ4��ˮ�����������ϡ���O-H-O����Ϊapm�������ӵ�������ֵΪNA����ñ���������ܶ�Ϊ____ g/cm3(�г�����ʽ����)��
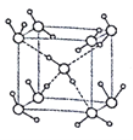
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ѿ̲��ݻ���������ӡȾ��ҵ��ɵ���Ⱦ��Ϊ���ء�ij�������ۺϴ�����NH4+ ��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO������������¹�ҵ���̣�

����˵���������
A. ����I����Ҫ���е�������N2��NO��CO
B. X�ڷ�Ӧ��������������ͨ������Ŀ���
C. ������NH4+��ˮʱ���������ӷ���ʽ�ǣ�NH4++NO2-=N2��+2H2O
D. ������������������Ҫ��CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��������������ٴ��ع��������ٿ����������˿���Ͻ�ֺ�ѧ��������������ʹ�����������������ٿ�(��Ҫ�ɷ�ΪCaWO4�������ж������衢������������)Ϊԭ��ұ���ߴ��Ƚ����٣���ҵ�������£�

��֪�����������Ժ�����������ˮ��
����ȫ�������ӵ�pHֵ��SiO32-Ϊ8��WO42-Ϊ5��
��̼�ͽ������ڸ����»ᷴӦ����̼���١�
�ش��������⣺
(1)��ҵ������������Ƶ�̼�����ƣ��˷������������Ϊ�ҹ�����ר�Һ�°���������ʳ��ˮ����ͨ��NH3����ͨ��CO2����������̼�����ƾ�����Ȼ����Һ��д���û�ѧ��Ӧ����ʽ��____________��
(2)�����а��ٿ�CaWO4�ʹ�����Ļ�ѧ��Ӧ����ʽ�ǣ�________________________��
(3)����B����Ҫ�ɷ��ǣ�д��ѧʽ��______������pH��ѡ�õ��Լ��ǣ�_____(��ѡ��)��
A.��ˮ B.���� C.NaOH��Һ D.Na2CO3��Һ
(4)�������C�Ƿ�ϴ�Ӹɾ��IJ�����________________________________________��
(5)Ϊ�˻�ÿ������Ƶ�˿�ĸߴ��Ƚ����٣�������̼����������������ԭ����ԭ����_________��
(6)���������Ƽ��������Ƽ�����Һ�пɵõ�����ƣ���֪ij�¶�ʱ��Ksp(CaWO4)=1��10-10��Ksp[Ca(OH)2]=4��10-7������Һ��WO42-ǡ�ó�����ȫ������Ũ�ȵ���10-5mol/L��ʱ����Һ��c(OH-)=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ������������������ֶ�����Ԫ�أ�����CΪ�������ڼ����Ӱ뾶��С��Ԫ�أ�0.1mol��L1A��B��D������������Ӧ��ˮ������Һ��ˮϡ��ʱ��Һ��pH�仯�����ͼ��������˵���в���ȷ����
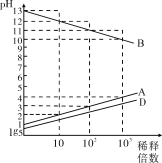
A. C�Ƶ�������ʢװA��D����ۺ������Ũ��Һ
B. AE3��D2E2����������ԭ���������ﵽ8���ӽṹ
C. B��D��E�ĵ��ʻ��������ж�����������Ư��������
D. ��ҵ�Ϸֱ������ڵ�B��E��C��E�γɵĻ������Ʊ�B��C����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com