
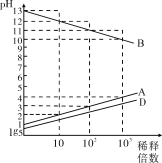
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是
A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
【答案】D
【解析】
第三周期简单离子中半径最小的是铝离子,所以C为铝;0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液pH分别为1、lg5、13,分别为一元强酸、二元强酸、一元强碱,其中A、B原子序数比铝小,只可能分别为氮和钠,D为硫,则E为氯;
A.铝制容器可盛装浓硫酸和浓硝酸,因为能被钝化,A项不符合题意;
B.AE3、D2E2分别为NCl3、S2Cl2,二者电子式分别为![]() 、
、![]() , B项不符合题意;
, B项不符合题意;
C.钠、硫、氯元素均可形成能作漂白剂的物质,如SO2、Na2O2、Cl2、ClO2、HClO,C项不符合题意;
D.工业上制备铝不能电解熔融的氯化铝,由于氯化铝为共价化合物,熔融状态下不导电,而是电解熔融的氧化铝, D项符合题意。
本题答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,是基态原子电子排布图的是________(填标号),能量(由低到高)排在第二位的是__________(填标号)。
A.![]()
B.![]()
C.![]()
D.![]()
(2)Li+与H-具有相同的电子构型,r(H-)______r(Li+)(填“<”或“>”),LiAlH4中,不存在_________(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(3)Li2O是离子晶体,其晶格能可通过图(a)的Bormi﹣Haber循环计算得到。

可知,Li2O晶格能为________kJmol﹣1,Li原子的第一电离能为_______kJmol﹣1,O=O键键能为________kJmol﹣1。
(4)Li2O晶胞如图所示。1个晶胞中有Li+______个,O2-_______个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() Cl表示中子数为18的氯元素的一种核素
Cl表示中子数为18的氯元素的一种核素
B.乙酸乙酯(CH3COOCH2CH3)和硬脂酸甘油酯(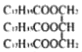 )互为同系物
)互为同系物
C.![]() 的名称为2﹣乙基丁烷
的名称为2﹣乙基丁烷
D.CH3(CH2)2CH3和CH(CH3)3互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)一定条件下,NO与NO2存在下列反应:NO(g) + NO2(g) ![]() N2O3(g),其平衡常数表达式为K = ____。
N2O3(g),其平衡常数表达式为K = ____。
(2)吸收时,尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋,好处是____。
(3)为提高Ca(NO2)2的产率及纯度,则n(NO)∶n(NO2)应控制为____。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为___。
II.铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原—氯化法可实现由铝土矿制备金属铝,相关的热化学方程式如下:
Al2O3(s) + AlCl3(g) + 3C(s) =3AlCl(g) + 3CO(g) △H = a kJ·mol—1
3AlCl (g)=2Al(l) + AlCl3(g) △H = bkJ·mol—1
则Al2O3(s) + 3C(s) =2Al(l) + 3CO(g) △H = __kJ·mol—1(用含a、b的代数式表示)。
(2)铝电池性能优越,Al—AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为____。
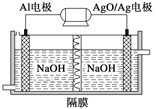
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15 分)化合物H 是合成药物盐酸沙格雷酯的重要中间体,其合成路线如下:
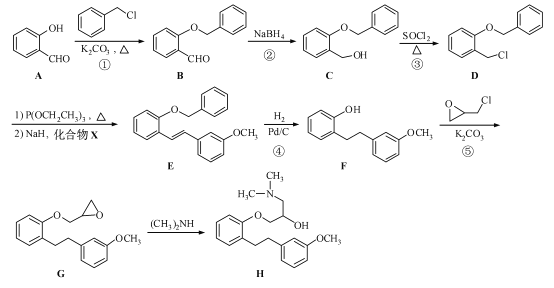
(1)化合物A 中的含氧官能团为 和 (填官能团名称)。
(2)反应①→⑤中,属于取代反应的是 (填序号)。
(3)写出同时满足下列条件的B 的一种同分异构体的结构简式: 。
I. 分子中含有两个苯环;II. 分子中有7 种不同化学环境的氢;III. 不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应。
(4)实现D→E 的转化中,加入的化合物X 能发生银镜反应,X 的结构简式为 。
(5)已知:![]() 。化合物
。化合物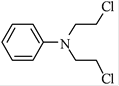 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以![]() 和
和![]() 为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是中学常见的强氧化剂,用固体碱熔氧化法制备KMnO4的流程和反应原理如图:

反应原理:
反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
请回答:
(1)下列操作或描述正确的是___
A.反应Ⅰ在瓷坩埚中进行,并用玻璃棒搅拌
B.步骤⑥中可用HCl气体代替CO2气体
C.可用玻璃棒沾取溶液于滤纸上,若滤纸上只有紫红色而无绿色痕迹,则反应Ⅱ完全
D.步骤⑦中蒸发浓缩至溶液表面有晶膜出现再冷却结晶:烘干时温度不能过高
(2)___(填“能”或“不能”)通入过量CO2气体,理由是___(用化学方程式和简要文字说明)。
(3)步骤⑦中应用玻璃纤维代替滤纸进行抽滤操作,理由是___。
草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.6000g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5025g已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。
记录实验数据如表
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
已知:MnO4﹣+C2O42﹣+H+→Mn2++CO2↑+H2O(未配平)
则KMnO4的纯度为___(保留四位有效数字);若滴定后俯视读数,结果将___(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应 8NH3+6NO2  12H2O+7N2可脱除烟气中的 NO2。下列有关该反应的说法中正确的是
12H2O+7N2可脱除烟气中的 NO2。下列有关该反应的说法中正确的是
A.NH3 是氧化剂
B.NO2 发生氧化反应
C.NO2在反应中得到电子
D.每生成 0.7mol N2,反应转移 2.4×6.02×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
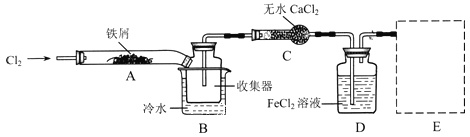
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端,要使沉积的FeCl3进入收集器,第④步操作是_______________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)_____________。
(4)装置B中冷水浴的作用为________________;装置C的名称为_____________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:____________。
(5)在虚线框中画出尾气吸收装置E并注明试剂_____________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为____________。
(7)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:①H2S的原子利用率为100%;②___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Na2CO3和NaHCO3的均匀混合物分成质量不等的三份,分别与50mL相同浓度的盐酸反应,得到气体的质量与固体混合物的质量关系如下表所示:
组 别 | 1 | 2 | 3 |
固体质量/g | 3.80 | 6.20 | 7.20 |
气体质量/g | 1.76 | 2.64 | 2.64 |
(1)上表中_______组数据表明盐酸参加反应后有剩余,理由是______________。
(2)上表中第2组数据中盐酸____________(填“过量”、“适量”、“不足量”)。
(3)通过计算求Na2CO3和NaHCO3的质量分数各为_________、____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com