
【题目】(15 分)化合物H 是合成药物盐酸沙格雷酯的重要中间体,其合成路线如下:
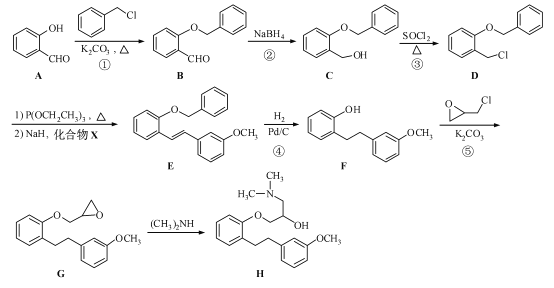
(1)化合物A 中的含氧官能团为 和 (填官能团名称)。
(2)反应①→⑤中,属于取代反应的是 (填序号)。
(3)写出同时满足下列条件的B 的一种同分异构体的结构简式: 。
I. 分子中含有两个苯环;II. 分子中有7 种不同化学环境的氢;III. 不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应。
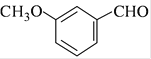
(4)实现D→E 的转化中,加入的化合物X 能发生银镜反应,X 的结构简式为 。
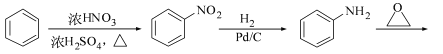
(5)已知:![]() 。化合物
。化合物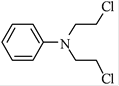 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以![]() 和
和![]() 为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
【答案】(1)羟基 醛基 (2)①③⑤
(3)![]() (或
(或![]() )
)
(4)
(5)
【解析】
(1)化合物A中的含氧官能团为羟基和醛基。(2)对比A、B的分子式知,①为A中酚羟基除H以外的部分取代了氯的位置,属于取代反应,②为醛基反应成羟基,去氧加氢,在有机中称为还原反应,③为氯原子取代羟基的取代反应,④为碳碳双键被加成,这属于还原反应,同时还少掉了含氧的苯环一部分,这应为取代反应,⑤为除氯以外的含氧环部分取代了F中羟基上的H,属于取代反应。(3)B的同分异构体不能与FeCl3发生显色,则无酚羟基存在,但是水解产生中含有酚羟基,故应为酚酯。再结合分子中有7种不同化学环境的氢,写出相应的结构。(4)X能发生银镜反应,则含有醛基,对比E和D的结构,可知X应为: 。(5)先在苯环上引入硝基,生成
。(5)先在苯环上引入硝基,生成![]() ,再将其还原得
,再将其还原得![]() ,
,![]() 断开氮氢键,
断开氮氢键,![]() 断开一个碳氧键,
断开一个碳氧键,![]() 与2分子
与2分子![]() 发生反应生成
发生反应生成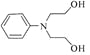 。根据题中C→D的转化,
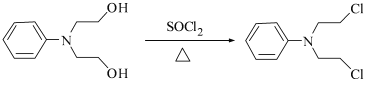
。根据题中C→D的转化,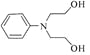 与SOCl2反应生成
与SOCl2反应生成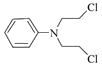 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知HX的酸性比HY弱,在物质的量浓度均为0.1molL﹣1的NaX和NaY混合溶液中,下列排序正确的是( )
A. c(OH﹣)>c(HX)>c(HY)>c(H+)
B. c(OH﹣)>c(X﹣)>c(Y﹣)>c(H+)
C. c(OH﹣)>c(Y﹣)>c(X﹣)>c(H+)
D. c(OH﹣)>c(HY)>c(HX)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(![]() )可用于照相业作定影剂。工业上可用反应:
)可用于照相业作定影剂。工业上可用反应:
![]() 制得。实验室模拟该工业过程制备硫代硫酸钠溶液(装置如图)。
制得。实验室模拟该工业过程制备硫代硫酸钠溶液(装置如图)。
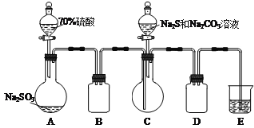
(1)装置A中反应的化学方程式___。
(2)装置B和D的作用是___。
(3)E中的试剂是___。
(4)反应一段时间后,装置C中得到产品是![]() ,其中还含有少量的
,其中还含有少量的![]() 。为测定装置C溶液中
。为测定装置C溶液中![]() 与
与![]() 的物质的量浓度之比,现进行如下实验:
的物质的量浓度之比,现进行如下实验:
步骤Ⅰ:取![]() 装置C烧瓶内的溶液置于锥形瓶中,加入足量的
装置C烧瓶内的溶液置于锥形瓶中,加入足量的![]() 溶液后再加入足量
溶液后再加入足量![]() 溶液,充分反应后,过滤,洗涤,干燥,得到固体的质量为
溶液,充分反应后,过滤,洗涤,干燥,得到固体的质量为![]() 。
。
步骤Ⅱ:另取![]() 装置C烧瓶内的溶液置于锥形瓶中,以淀粉作指示剂,用
装置C烧瓶内的溶液置于锥形瓶中,以淀粉作指示剂,用![]() 碘标准溶液滴定,滴定至终点消耗碘的标准溶液体积为
碘标准溶液滴定,滴定至终点消耗碘的标准溶液体积为![]() 。该步骤中发生的反应为
。该步骤中发生的反应为![]() ;计算装置C溶液中
;计算装置C溶液中![]() 与
与![]() 的物质的量浓度之比___(写出计算过程)。
的物质的量浓度之比___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4FeO42﹣+10H2O═4Fe(OH)3↓+8OH﹣+3O2↑,测得c(FeO42﹣)在不同条件下变化如图甲、乙、丙、丁所示:
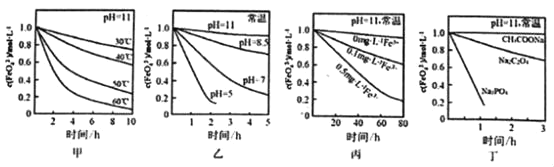
下列说法正确的是( )
A.图甲表明,其他条件相同时,温度越低FeO42﹣转化速率越快
B.图乙表明,其他条件相同时,碱性越强FeO42﹣转化速率越快
C.图丙表明,其他条件相同时,碱性条件下Fe3+能加快FeO42﹣的转化
D.图丁表明,其他条件相同时,钠盐都是FeO42﹣优良的稳定剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类非常重要的反应。回答下列问题:
(1)按如图所示操作,充分反应后:
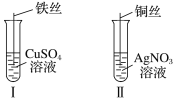
①Ⅰ中发生反应的离子方程式为__________________________________;
②Ⅱ中铜丝上观察到的现象是___________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_____________。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。其中氧化产物是________
(3)人体内的铁元素是以Fe2+和Fe3+的形式存在。Fe2+易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有_______(填“氧化性”或“还原性”)。
(4)市场上出售的某种麦片中含有微量还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为________________________________________________
(5)写出氢气还原氧化铜反应的化学方程式,并用双线桥法表示电子转移的方向和数目。________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是
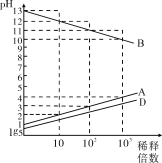
A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原子在处于能量最低状态时,外围电子排布为![]() ,则下列说法错误的是
,则下列说法错误的是
A. 该元素可能有+3价
B. 该元素位于第5周期副族
C. 该元素原子核外共有39个不同运动状态的电子
D. 该元素基态原子第N能层上还有5个空轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为主要原料合成一种具有果香味的物质 C 和化合物 D 的合成路线如图所示。
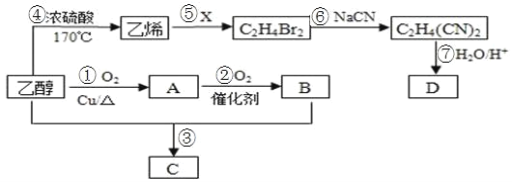
请回答下列问题:
(1)B的结构简式为_______。
(2)反应⑤的化学方程式为_______;B分子中的官能团名称为_______;反应⑥的类型为________。
(3)为了探究反应③的反应原理,通常采用“同位素示踪法”的方法,请结构简式为 CH3CH218OH,书写化反应③学方程式为_______。
(4)已知D的相对分子量为 118,其中碳、氢两元素的质量分数分别为 40.68%、5.08%,其余为氧元素,则 D 的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
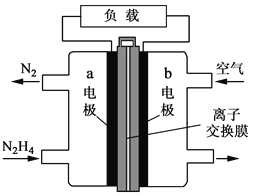
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com