
����Ŀ��KMnO4����ѧ������ǿ���������ù�������������Ʊ�KMnO4�����̺ͷ�Ӧԭ����ͼ��

��Ӧԭ����
��ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
��Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3
��ī��ɫ�� ���Ϻ�ɫ��
��֪25�����ʵ��ܽ��g/100gˮ
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
��ش�
��1�����в�����������ȷ����___
A����Ӧ���ڴ������н��У����ò���������
B����������HCl�������CO2����
C�����ò�����մȡ��Һ����ֽ�ϣ�����ֽ��ֻ���Ϻ�ɫ������ɫ�ۼ�����Ӧ����ȫ
D�������������Ũ������Һ�����о�Ĥ��������ȴ�ᾧ�����ʱ�¶Ȳ��ܹ���
��2��___����������������������ͨ�����CO2���壬������___���û�ѧ����ʽ�ͼ�Ҫ����˵������
��3���������Ӧ�ò�����ά������ֽ���г��˲�����������___��
�����Ƶζ�������������ش��Ȳ������£�
��ȡ1.6000g������ز�Ʒ�����100mL��Һ
��ȷ��ȡ����0.5025g�Ѻ�ɵ�Na2C2O4��������ƿ�У�������������ˮʹ���ܽ⣬�ټ������������ữ��
����ƿ����Һ���ȵ�75��80�棬������I�����Ƶĸ��������Һ�ζ����յ㡣
��¼ʵ���������
ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
��֪��MnO4��+C2O42��+H+��Mn2++CO2��+H2O��δ��ƽ��
��KMnO4�Ĵ���Ϊ___��������λ��Ч���֣������ζ����Ӷ����������___������ƫ��������ƫ����������Ӱ��������
���𰸡�CD ���� K2CO3+CO2+H2O=2KHCO3 KHCO3�ܽ�ȱ�K2CO3С�ö࣬Ũ��ʱ���KMnO4һ������ 74.06% ƫ��
��������
��ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O����Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3���������Һ���ȹ��˵õ���Һ�к���KMnO4��K2CO3������ΪMnO2��
3K2MnO4+KCl+3H2O����Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3���������Һ���ȹ��˵õ���Һ�к���KMnO4��K2CO3������ΪMnO2��
��1��A��KOH����״̬���ܺͶ������跴Ӧ��
B�����������Һ����ǿ�����ԣ����������
C���������Һ����ɫ�����������Һ����ɫ��
D���¶ȹ��ߵ��¸�����طֽ⣻
��2��KHCO3�ܽ�ȱ�K2CO3С�ö࣬Ũ��ʱ���KMnO4һ��������
��3��KMnO4��Һ����ǿ�����ԣ��ḯʴ��ֽ��
���ݵ���غ㡢ת�Ƶ����غ㡢ԭ���غ���ƽ����ʽΪ2MnO4��+5C2O42��+16H��=2Mn2��+10CO2��+8H2O��
1�и��������Һ���=��22.67-2.65��mL=20.02mL��2�и��������Һ���=��23.00-2.60��mL=20.40mL��3�и��������Һ���=��22.56-2.58��mL=20.02mL��2����Һ���ƫ��ϴ���ȥ��ƽ�����������Һ���=20.02mL��n��KMnO4��=![]() n��Na2C2O4��=
n��Na2C2O4��=![]() ��
��![]() =
=![]() ��0.00375mol=0.0015mol���������������=
��0.00375mol=0.0015mol���������������=![]() ��0.1L��158g/mol=1.1838g��
��0.1L��158g/mol=1.1838g��
���ζ����Ӷ�����������Һ���ƫ�͡�
��ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O����Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3���������Һ���ȹ��˵õ���Һ�к���KMnO4��K2CO3������ΪMnO2��
3K2MnO4+KCl+3H2O����Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3���������Һ���ȹ��˵õ���Һ�к���KMnO4��K2CO3������ΪMnO2��
��1��A��KOH����״̬���ܺͶ������跴Ӧ�����Բ����ô�������Ӧ��������������A����
B�����������Һ����ǿ�����ԣ����������ᣬ���Բ�����ϡ���ᣬ��B����
C���������Һ����ɫ�����������Һ����ɫ�����Ը�����ɫ�����жϣ���C��ȷ��
D���¶ȹ��ߵ��¸�����طֽ⣬������Ҫ���£���D��ȷ��
��ѡCD��
��2��KHCO3�ܽ�ȱ�K2CO3С�ö࣬Ũ��ʱ���KMnO4һ�������������ķ�ӦΪK2CO3+CO2+H2O=2KHCO3�����Բ���ͨ�����������̼��
��3��KMnO4��Һ����ǿ�����ԣ��ḯʴ��ֽ������Ӧ���ò���ֽ��
���ݵ���غ㡢ת�Ƶ����غ㡢ԭ���غ���ƽ����ʽΪ2MnO4��+5C2O42��+16H+=2Mn2++10CO2��+8H2O��1�и��������Һ���=��22.67��2.65��mL=20.02mL��2�и��������Һ���=��23.00��2.60��mL=20.40mL��3�и��������Һ���=��22.56��2.58��mL=20.02mL��2����Һ���ƫ��ϴ���ȥ��ƽ�����������Һ���=20.02mL��n��KMnO4��=![]() n��Na2C2O4��=
n��Na2C2O4��=![]() ��
��![]() =
=![]() ��0.00375mol=0.0015mol���������������=
��0.00375mol=0.0015mol���������������=![]() ��0.1L��158g/mol=1.1838g���䴿��=
��0.1L��158g/mol=1.1838g���䴿��=![]() ��100%=74.06%��
��100%=74.06%��
���ζ����Ӷ�����������Һ���ƫ�ͣ���ҺŨ��ƫ�ߡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�ӷ�Ӧ�ѵ�ԭ�ϣ������˵Ļ�������UF4��UO2��(NH4)4[UO2(CO3)3]�ȡ��ش��������⣺
(1)UF4��Mg��Ca��ԭ�ɵý����ˡ����ͬ���ڻ�̬ԭ�ӵ�δ�ɶԵ�����Ϊ2��Ԫ�ع���___�֣�ԭ������ΪþԪ�صĶ�����Ԫ�صĻ�̬ԭ�Ӽ۵����Ų�ͼΪ_______��
(2)��֪��2UO2+5NH4HF2 150�� 2UF4��NH4F+3NH3��+4H2O�� HF2-�ĽṹΪ[F-H��F]-
��NH4HF2�к��еĻ�ѧ����__________ (��ѡ����ĸ)��
A.��� B.��λ�� C.���ۼ� D.���Ӽ� E.������
������ͬ���ڣ��ҵ�һ�����ܱ������Ԫ����______�֡�
(3)��֪��3(NH4)4[UO2(CO3)3] 800�� 3UO2+10NH3��+9CO2��+N2��+9H2O��
������ ����CO32-��̼ԭ���ӻ�������ͬ�Ͳ�ͬ��̼ԭ�ӵĸ�����Ϊ______��
����CO32-��̼ԭ���ӻ�������ͬ�Ͳ�ͬ��̼ԭ�ӵĸ�����Ϊ______��
�ڷֽ����õ���̬������ķ��Ӽ�����С�����˳��Ϊ_________(�ѧʽ)
(4)�������з�ʽ�У�ͨ��������Cu�ľ���Ķѻ���ʽ��_________(�����)��
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
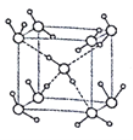
(5)ˮ�ڲ�ͬ���¶Ⱥ�ѹ�������¿��γ�11�ֲ�ͬ�ṹ�ľ��壬�ܶȴӱ�ˮ���0.92g/cm3��ԼΪˮ��1.5������������������֪����һ�ּ��Ӷѻ����ṹ�������Ļ�������б�- ���ľ���ṹΪһ����ͼ��ʾ������������ÿ��ˮ��������Χ4��ˮ�����������ϡ���O-H-O����Ϊapm�������ӵ�������ֵΪNA����ñ���������ܶ�Ϊ____ g/cm3(�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
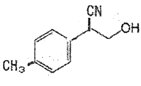
����Ŀ�������廯����A��C9H11Br)������ҩ�P���ϵĺϳɣ�A����ͼת����ϵ�����ַ�Ӧ������ȥ����

��֪����A�Ƿ����廯�����ҷ��Ӳ����ϵ���ԭ��ֻ��1�ֻ�ѧ������
�� +CO2
+CO2
(1)I�к��������ŵ�����Ϊ___��___��
(2)��A����B�Ļ�ѧ����ʽΪ___��
(3)C��I�ķ�Ӧ����Ϊ___��
(4)������֪��Ϣ������![]() ������KMnO4��Һ�����������л�����Ľṹ��ʽ��___��
������KMnO4��Һ�����������л�����Ľṹ��ʽ��___��
(5)д����������������G��һ��ͬ���칹��Ľṹ��ʽ��___��
�����ڷ����廯����Һ˴Ź���������4���壻
���ܷ���ˮ�ⷴӦ��������Ӧ��������FeCl3��Һ������ɫ��Ӧ
(6)�����ͪ(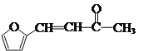 )��һ����Ҫ��ҽҩ�м��壬д����
)��һ����Ҫ��ҽҩ�м��壬д����![]() ��
��![]() Ϊԭ���Ʊ������ͪ�ĺϳ�·��ͼ___�����Լ����л��ܼ����ã��ϳ�·��ͼʾ����������ɣ���
Ϊԭ���Ʊ������ͪ�ĺϳ�·��ͼ___�����Լ����л��ܼ����ã��ϳ�·��ͼʾ����������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п��һ�ֶ���Ե����������ϡ�ijС���Դ�����п��������ͭ�������Ϊԭ��ģ�ҵ������������п��������ͼ��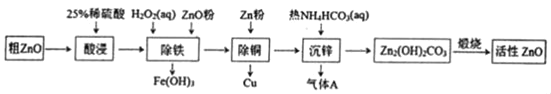
��֪��������������pH��Χ�����ʾ
Zn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ���� | 5.4 | 7.0 | 2.3 | 4.7 |
��ȫ���� | 8.0 | 9.0 | 4.1 | 6.7 |
����˵������ȷ���ǣ� ��
A.���������25%ϡ�������98%Ũ�������ƣ��貣�������ձ�������ͷ�ιܵ�����
B.������������ZnO�۵�����ҺpH��4.1��4.7
C.����ͭ���м���Zn�۹������Ʊ���������п�IJ���û��Ӱ��
D.����п����ӦΪ2Zn2++4HCO3���TZn2��OH��2CO3��+3CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ������������������ֶ�����Ԫ�أ�����CΪ�������ڼ����Ӱ뾶��С��Ԫ�أ�0.1mol��L1A��B��D������������Ӧ��ˮ������Һ��ˮϡ��ʱ��Һ��pH�仯�����ͼ��������˵���в���ȷ����
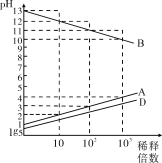
A. C�Ƶ�������ʢװA��D����ۺ������Ũ��Һ
B. AE3��D2E2����������ԭ���������ﵽ8���ӽṹ
C. B��D��E�ĵ��ʻ��������ж�����������Ư��������
D. ��ҵ�Ϸֱ������ڵ�B��E��C��E�γɵĻ������Ʊ�B��C����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijþȼ�ϵ����þƬ��ʯī��Ϊ�缫����ط�ӦΪ��Mg+H2O2+ H2SO4��MgSO4 +2H2O�� ��ع���ʱ������˵����ȷ����
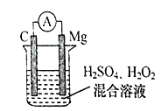
A.þƬ��������С
B.þƬ�ǵ�ص�����
C.������þƬ ����������ʯī��
D.þƬ�Ϸ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.2 mol�������ƺ�0.1 mol�������Ƶ���Һ�У������ȶ���ͨ�������̼���壬ͨ������Ϊ6.72 L����״����ʱ������ֹͣ������һ�����У���Һ��������Ŀ��ͨ�������̼��������Ĺ�ϵ��ȷ���ǣ�������������ܽ⣩
A.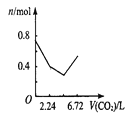 B.
B.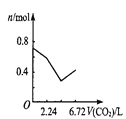 C.
C.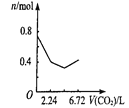 D.
D.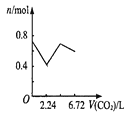
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)


A. ͼ���Ц�H1����H2����H3
B. ͼ���ڴ��������£���Ӧ�Ļ�ܵ���E1��E2
C. ͼ�۱�ʾ������Һ�ζ� NaOH��Һ�Ͱ�ˮ�����Һ�ĵ絼�ʱ仯����
D. ͼ�ܿɱ�ʾ��CO(g)����CO2(g)�Ĺ�����Ҫ�ų�566 kJ ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������£�����������Һ����0.1 mol��L-1 NH4Cl��Һ����0.1 mol��L��1 CH3COONH4��Һ����0.1 mol��L��1 NH4HSO4��Һ����0.1 mol��L��1��ˮ ��0.1 mol��L��1 NH3��H2O��0.1 mol��L��1 NH4Cl���Һ
�����Ҫ����д���пհף�
(1)��Һ�ٳ�_______(������������������������)�ԣ���ԭ����___________(�����ӷ���ʽ��ʾ)��
(2)����5����Һ�У�����ˮ�ĵ���̶�������_______(�����)
(3)�������١��ڡ��ۡ�����Һ��c(NH4+)Ũ���ɴ�С��˳����_____________��(�����)
(4) �����£������Һ�ڵ�pH��7����CH3COO����NH4+Ũ�ȵĴ�С��ϵ��c(CH3COO��)______c(NH4+)(��������������������=��)��
(5)�ñ�������Һ�ζ�δ֪Ũ�ȵİ�ˮʵ�顣�ζ���ѡ�õ�ָʾ��Ϊ_______(������������ ����̪��)�������ζ���ʼʱ�ζ��ܼ��촦�����ݣ����ʱ�ζ��ܼ��촦�������ݣ���ᵼ�µζ����______(����ƫ������ ��ƫ����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com