
【题目】下列说法正确的是( )


A. 图①中ΔH1=ΔH2+ΔH3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
C. 图③表示醋酸溶液滴定 NaOH溶液和氨水混合溶液的电导率变化曲线
D. 图④可表示由CO(g)生成CO2(g)的过程中要放出566 kJ 热量
【答案】C
【解析】
试题根据盖斯定律来可知:一个反应无论是一步完成还是分为数步完成,其热效应是相同的,故应有:△H1=-△H2-△H3,A错误;E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,B错误;氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,C正确;图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,D错误。


科目:高中化学 来源: 题型:
【题目】对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br-
B.SO42-
C.H2SO3
D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___(填选项);
A.2v生(NH3)=v耗(CO2)
B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变
D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___(填选项);
A.及时分离出CO2气体
B.适当升高温度
C.加入少量NH2COONH4(s)
D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1 mol·L1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
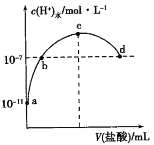
A. 常温下,0.1 mol·L1氨水中NH3·H2O的电离常数K约为1×10-6
B. a、b之间的点一定满足:c(NH4+) > c(Cl) > c(H+) > c(OH)
C. b、d点溶液中都满足c(NH4+)=c(Cl)
D. c点代表两溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞( )是一种治疗脑血管疾病的药物,它的一种合成路线如图:
)是一种治疗脑血管疾病的药物,它的一种合成路线如图:

已知:
(1)Y的名称是_____。
(2)H的结构简式为___。
(3)X→Y的反应类型是_____。H→丁苯酚的“一定条件”指_____。
(4)写出W→X的化学方程式:_____。
(5)W的二溴代物有___种,其中一种在核磁共振氢谱上有3组峰的结构为___(填结构简式)。
(6)以某烯烃为原料合成(CH3)3CMgBr,参照上述流程,设计合成路线。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种航天器能量储存系统原理示意图。下列说法正确的是
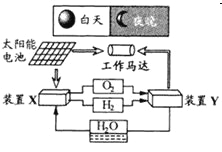
A. 该系统中只存在3种形式的能量转化
B. 装置Y中负极的电极反应式为:![]()
C. 装置X能实现燃料电池的燃料和氧化剂再生
D. 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
(1)A在元素周期表中的位置___,B的离子结构示意图___,化合物NH4D(含D-的铵盐)的电子式___。
(2)C的某种简单阳离子,其原子核中含22个中子,其化学符号为___;元素D最高价氧化物的水化物化学式为___。
(3)B、C、E三种元素的金属性按照由强到弱的顺序排列应为:___(用元素符号表示)。
(4)写出单质B和氢氧化钠溶液反应的离子方程式:___。
(5)写出E与冷水反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如图所示:
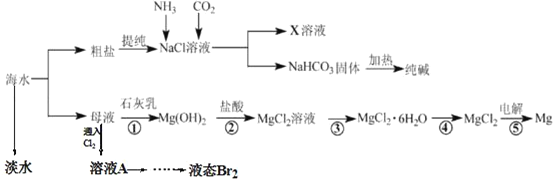
(1)从海水中获得淡水的装置如图,其中有_____处错误。

(2)在母液中通入氯气的离子方程式为_____,从溶液A中提取Br2,需要的主要仪器是____
(3)操作③是_____
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质。
①为制得纯净的NaCl晶体,操作如下:
a.溶解;
b.依次加入过量的_____溶液、NaOH溶液、_____溶液;
c._____;
d.加适量盐酸;
e._____(请补全缺少的试剂和实验步骤)
②步骤b中,加入最后一种试剂发生反应的离子方程式为_____
(5)用这种方法制得的Na2CO3中有少量的NaCl,检验NaCl的实验为_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com