
【题目】下列A~J十种物质之间的转化关系如图所示,其中部分生成物或反应条件已略去。A为正盐;常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H为黄绿色气体,I通常为红棕色气体,I的相对分子质量比E的大16;F在常温下是一种无色液体;G能在H中燃烧,发出苍白色火焰,产物C易溶于水;J是一元含氧强酸。
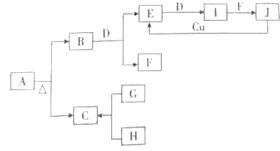
回答下列问题:
(1)A的化学式为_________。
(2)一定条件下,B和D反应生成E和F的化学方程式为_____________。
(3)J和金属Cu反应生成E的化学方程式为_______。
(4)H和石灰乳反应的化学方程式为___________。
(5)在I和F的反应中,氧化剂和还原剂的质量之比为__________。
【答案】NH4Cl 4NH3+5O2![]() 4NO+6H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O 1:2
4NO+6H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O 1:2
【解析】
根据题目提供的转化关系,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H为黄绿色气体则为氯气,I通常为红棕色气体则为NO2,I的相对分子质量比E的大16,则E为NO;F在常温下是一种无色液体则为H2O;G能在H中燃烧,发出苍白色火焰,则G为氢气,产物C易溶于水为氯化氢;J是一元含氧强酸且可由NO2与水反应得到,则为HNO3。NO与D反应生成NO2,D为单质,则D为氧气,B与氧气反应生成NO和水,则B为氨气,A为正盐,加热得到氨气和氯化氢,则A为氯化铵。
(1)A为氯化铵,其化学式为NH4Cl;
(2)一定条件下,B(NH3)和D(O2)反应生成E(NO)和F(H2O)的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)J(HNO3)和金属Cu反应生成E(NO)的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(4)H为氯气,和石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;
(5)在I和F的反应3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量之比为1:2。


科目:高中化学 来源: 题型:
【题目】化学反应N2(g)+3H2(g) ![]() 2NH3(g)的能量变化如图所示(△E为能量变化值,a、b、c均为正值)。下列相关说法正确的是
2NH3(g)的能量变化如图所示(△E为能量变化值,a、b、c均为正值)。下列相关说法正确的是

A. 此反应为吸热反应
B. 1mol N+3mol H中的总能量等于1mol NH3中的能量
C. 1mol NH3(l)转变为1mol NH3(g)需要吸收c kJ能量
D. 反应N2(g)+3H2(g) ![]() 2NH3(g)的能量变化值为a+b
2NH3(g)的能量变化值为a+b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 标准状况下,2.24 L水中所含电子总数为NA
B. 将27 g Al加入到1 mol/L的NaOH溶液中反应,转移的电子数为3NA
C. 100 mL 2 mol/L的Na2CO3溶液中含有的离子总数为0.6NA
D. 7.8 g Na2O2固体中含有0.3NA个离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.1 mol·L-1
B. 通入CO2的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3) = 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:
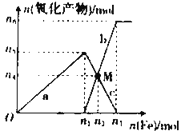
回答下列问题:
(1)与曲线a对应的离子方程式为_____。
(2)曲线b代表的微粒为_____________,n2的值为__________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为_____________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以进行实验并能达到实验目的的是
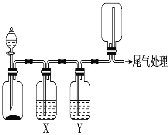
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 用CaO与浓氨水制取并收集纯净干燥的NH3 | NaOH溶液 | 碱石灰 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,是基态原子电子排布图的是________(填标号),能量(由低到高)排在第二位的是__________(填标号)。
A.![]()
B.![]()
C.![]()
D.![]()
(2)Li+与H-具有相同的电子构型,r(H-)______r(Li+)(填“<”或“>”),LiAlH4中,不存在_________(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(3)Li2O是离子晶体,其晶格能可通过图(a)的Bormi﹣Haber循环计算得到。

可知,Li2O晶格能为________kJmol﹣1,Li原子的第一电离能为_______kJmol﹣1,O=O键键能为________kJmol﹣1。
(4)Li2O晶胞如图所示。1个晶胞中有Li+______个,O2-_______个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置及原理正确的是( )
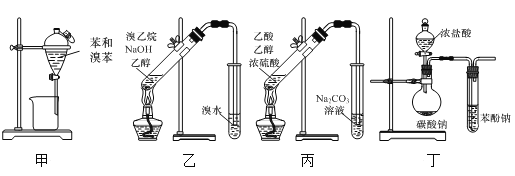
A.用图甲装置分离苯和溴苯的混合物
B.用图乙装置检验溴乙烷的消去产物
C.用图丙装置制取并收集乙酸乙酯
D.用图丁装置验证酸性:碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)一定条件下,NO与NO2存在下列反应:NO(g) + NO2(g) ![]() N2O3(g),其平衡常数表达式为K = ____。
N2O3(g),其平衡常数表达式为K = ____。
(2)吸收时,尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋,好处是____。
(3)为提高Ca(NO2)2的产率及纯度,则n(NO)∶n(NO2)应控制为____。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为___。
II.铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原—氯化法可实现由铝土矿制备金属铝,相关的热化学方程式如下:
Al2O3(s) + AlCl3(g) + 3C(s) =3AlCl(g) + 3CO(g) △H = a kJ·mol—1
3AlCl (g)=2Al(l) + AlCl3(g) △H = bkJ·mol—1
则Al2O3(s) + 3C(s) =2Al(l) + 3CO(g) △H = __kJ·mol—1(用含a、b的代数式表示)。
(2)铝电池性能优越,Al—AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为____。
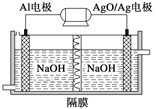
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com