
【题目】在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:
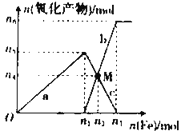
回答下列问题:
(1)与曲线a对应的离子方程式为_____。
(2)曲线b代表的微粒为_____________,n2的值为__________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为_____________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为_________。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O Fe2+ 0.6 0.2 8Fe+3NO3-+30H+=8Fe3++3NH4++9H2O
【解析】
向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)= Fe(NO3)3+NO↑+2H2O,Fe(NO3)3与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2 Fe(NO3)3+Fe=3 Fe(NO3)2,由此分析解答。
(1)曲线a代表Fe+4HNO3(稀)= Fe(NO3)3+NO↑+2H2O,离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O;
(2)根据反应Fe+4 HNO3(稀)= Fe(NO3)3+NO↑+2H2O,1 L 2 mol·L-1稀硝酸溶液参与反应,则此时消耗Fe的物质的量为0.5mol,曲线b代表的微粒为亚铁离子,加铁粉从n1到n2发生反应2Fe(NO3)3+Fe=3Fe(NO3)2,且M点n(Fe3+)=n(Fe2+),
即 2Fe3+~~~Fe~~~3Fe2+,
开始0.5mol 0 0
转化 2x x 3x
M点 0.5-2x 3x
所以0.5-2x =3x,x=0.1mol,故M点消耗铁的物质的量为0.5mol+0.1mol=0.6mol;
(3)M点时再加入VL2mol/L的稀硝酸,恰好反应完全,说明硝酸与0.6mol的铁恰好完全反应生成铁离子,而稀硝酸参加氧化还原反应,氧化性的硝酸占![]() ,根据得失电子守恒得3×0.6mol=
,根据得失电子守恒得3×0.6mol=![]() ×2×(1+V)×3,解之得V=0.2L;
×2×(1+V)×3,解之得V=0.2L;
(4)极稀的硝酸液中加入少量铁粉,生成NH4+的离子方程式为:8Fe+3NO3-+30H+=8Fe3++3NH4++9H2O。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】青蒿酸是合成青蒿素的原料,可以由香草醛合成:

下列有关叙述正确的是
A. 香草醛的分子式是C8H10O3
B. 香草醛能与NaHCO3溶液反应
C. 两种物质均可与溴的四氯化碳溶液发生加成反应
D. 可用FeCl3溶液检验青蒿酸中是否含香草醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程图如下。回答下列问题:

(1)精制食盐水时下列物质中,用到的有______________________(填序号)。
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工业上经过②、③、④制备Ba2。步骤②中Cl2氧化Br-应在________(填酸性或碱性)条件下进行;步骤③Br2可用热空气吹出,其原因是_____________________。
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 ________________(写出加入的试剂和操作)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应是在高温、高压和有催化剂存在的条件下,用氢气和氮气直接化合制取:3H2+N2![]() 2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
A.为了提高H2的转化率。应适当提高N2的浓度
B.达到平衡时,c(NH3)一定是c(H2)的三分之二
C.使用催化剂是为了加快反应速率,提高生产效率
D.达到平衡时,氨气分解速率是氮气消耗速率的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法的名称是______________。
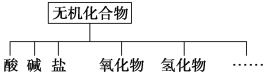
(2)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥_______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
(3)写出⑦转化为⑤的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A~J十种物质之间的转化关系如图所示,其中部分生成物或反应条件已略去。A为正盐;常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H为黄绿色气体,I通常为红棕色气体,I的相对分子质量比E的大16;F在常温下是一种无色液体;G能在H中燃烧,发出苍白色火焰,产物C易溶于水;J是一元含氧强酸。
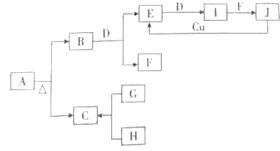
回答下列问题:
(1)A的化学式为_________。
(2)一定条件下,B和D反应生成E和F的化学方程式为_____________。
(3)J和金属Cu反应生成E的化学方程式为_______。
(4)H和石灰乳反应的化学方程式为___________。
(5)在I和F的反应中,氧化剂和还原剂的质量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HX的酸性比HY弱,在物质的量浓度均为0.1molL﹣1的NaX和NaY混合溶液中,下列排序正确的是( )
A. c(OH﹣)>c(HX)>c(HY)>c(H+)
B. c(OH﹣)>c(X﹣)>c(Y﹣)>c(H+)
C. c(OH﹣)>c(Y﹣)>c(X﹣)>c(H+)
D. c(OH﹣)>c(HY)>c(HX)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:

下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4FeO42﹣+10H2O═4Fe(OH)3↓+8OH﹣+3O2↑,测得c(FeO42﹣)在不同条件下变化如图甲、乙、丙、丁所示:
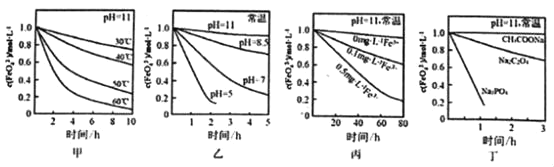
下列说法正确的是( )
A.图甲表明,其他条件相同时,温度越低FeO42﹣转化速率越快
B.图乙表明,其他条件相同时,碱性越强FeO42﹣转化速率越快
C.图丙表明,其他条件相同时,碱性条件下Fe3+能加快FeO42﹣的转化
D.图丁表明,其他条件相同时,钠盐都是FeO42﹣优良的稳定剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com