
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、苯与溴水反应生成溴苯 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |


科目:高中化学 来源: 题型:
| A、4种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
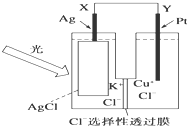 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O(g)═H2O(l)△H=-44kJ/mol |
| B、2HI(g)═H2(g)+I2(g)△H=+14.9kJ/mol |
C、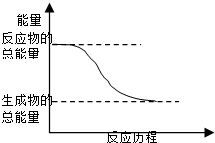 能量变化如图所示的化学反应 |
| D、形成化学键时放出能量的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.5 g Al与足量盐酸反应生成H2的分子数为NA |
| B、标准状况下,2.24 L CH4所含电子数为NA |
| C、500 mL 1 mol?L-1的K2SO4溶液中含有K+数目为NA |
| D、0.5 mol O2和0.5 mol O3的混合物所含有的氧原子个数为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
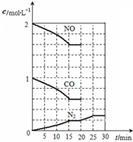 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(K) | 273 | 293 | 313 | 333 | 353 | 373 |
| Ca(OH)2溶解度(g/100g H2O) | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加足量草酸H2C2O4. | 出现白色沉淀(CaC2O4),说明该试剂中有Ca2+存在. |
| 步骤3:取适量步骤1中的沉淀于试管中, | |
| 步骤4: | 现象是 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com