
 ,由A、B两元素形成的18电子微粒为双氧水,其中所含化学键类型为极性共价键、非极性共价键,
,由A、B两元素形成的18电子微粒为双氧水,其中所含化学键类型为极性共价键、非极性共价键, ;极性共价键、非极性共价键;
;极性共价键、非极性共价键;

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
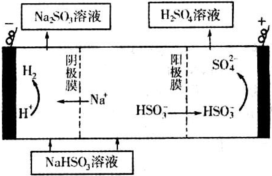 某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.
某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H216O中,质量数之和是质子数之和的两倍 |
| B、在纯水中加入少量铵盐不会对水的电离产生影响 |
| C、100℃时,纯水的pH=7 |
D、H2O的电子式为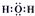 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、苯与溴水反应生成溴苯 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol SiO2晶体中有2NA个Si-O键 |
| B、0.5 mol I-被氧化时失去的电子数为0.5NA |
| C、在0℃,压强为1.01×105 Pa时,11.2 L SO3所含原子数目为2NA |
| D、常温常压下,48 g O3含有氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
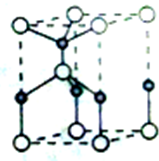 利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为
利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为查看答案和解析>>
科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
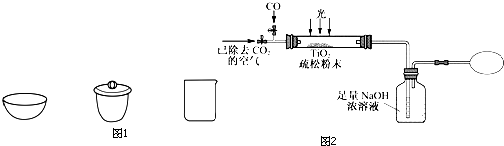
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①B2H6 |
| ②H2O2/OH- |

查看答案和解析>>
科目:高中化学 来源: 题型:
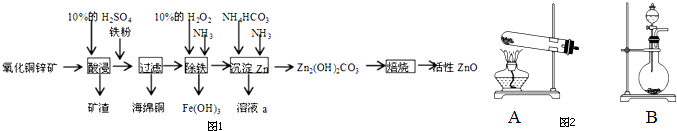
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com