
| A、1 mol SiO2晶体中有2NA个Si-O键 |
| B、0.5 mol I-被氧化时失去的电子数为0.5NA |
| C、在0℃,压强为1.01×105 Pa时,11.2 L SO3所含原子数目为2NA |
| D、常温常压下,48 g O3含有氧原子数为3NA |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、合金材料中不可能含有非金属元素 |
| B、SiO2为酸性氧化物,故不能与任何酸发生化学反应 |
| C、用砂纸打磨过的铝箔放在洒精灯焰上不燃烧,说明铝不易与O2反应 |
| D、FeCl2、FeCl3、Fe(OH)3三种物质都可以直接通过化合反应制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
| B、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
| C、2012年诺贝尔化学奖授予两位美国科学家罗伯特?莱夫科维茨和布莱恩?克比尔卡,以表彰他们在“G蛋白偶联受体研究”中取得的重大成就 |
| D、道尔顿、李比希、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O(g)═H2O(l)△H=-44kJ/mol |
| B、2HI(g)═H2(g)+I2(g)△H=+14.9kJ/mol |
C、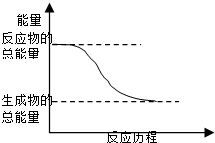 能量变化如图所示的化学反应 |
| D、形成化学键时放出能量的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol铁与足量盐酸完全反应转移的电子数目为3NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为NA |
| C、100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA |
| D、32g氧气和32g臭氧(O3)所含有的氧原子数之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:
(1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:| 离子 | Na+ | K+ | XO32- | SO42- |
| 浓度(mol?L-1) | 0.3 | 0.2 | 0.05 | 0.15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com