
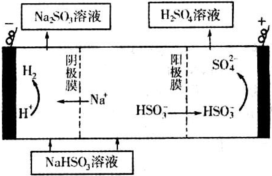
 某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.
某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3 mol NO2和0.3 mol NO |
| B、0.1 mol NO、0.2 mol NO2和0.05 mol N2O4 |
| C、0.2 mol NO2和0.1 mol N2O4 |
| D、0.6 mol NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金材料中不可能含有非金属元素 |
| B、SiO2为酸性氧化物,故不能与任何酸发生化学反应 |
| C、用砂纸打磨过的铝箔放在洒精灯焰上不燃烧,说明铝不易与O2反应 |
| D、FeCl2、FeCl3、Fe(OH)3三种物质都可以直接通过化合反应制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v (O2)=0.0l mol?L-1?s-1 |
| B、v (NO)=0.001 mol?L-1?s-1 |
| C、v (NH3)=0.001 mol?L-1?s-1 |
| D、v (H2O)=0.003 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com