
| A、0.3 mol NO2和0.3 mol NO |
| B、0.1 mol NO、0.2 mol NO2和0.05 mol N2O4 |
| C、0.2 mol NO2和0.1 mol N2O4 |
| D、0.6 mol NO |
| 10.2g |
| 17g/mol |
| 10.2g |
| 17g/mol |


科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积(Ksp) | 1.4×10-10 | 1.4×10-5 | 1.4×10-50 | 1.4×10-13 | 1.4×10-16 |
| A、在AgCl,Ag2SO4,AgBr,AgI饱和溶液中分别滴加Na2S溶液现象相同 |
| B、25℃时,5种银盐饱和溶液中c(Ag+)最大的是Ag2SO4 |
| C、25℃时,在等物质的量浓度NaCl的溶液和CaCl2溶液中加入足量的AgCl固体,形成饱和溶液,两溶液中溶液积相同,但c(Ag+)不同 |
| D、AgBr沉淀可转化为AgI沉淀,而AgI沉淀不可能转化为AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
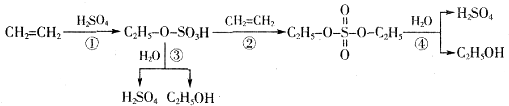
| A、该过程是一种“对环境友好型”工业生产硫酸的方法 |
| B、从以上物质的转化过程可看出硫酸可作乙烯水化法制乙醇的催化剂 |
| C、该过程中①②是加成反应 |
| D、该过程中③④是酯类的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
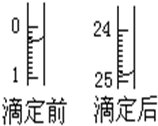 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室蒸馏石油时,冷凝管水流方向应从上到下与蒸汽流动方向相同 |
| B、蒸发结晶时不必将溶液加热到蒸干 |
| C、萃取操作必须在分液漏斗中进行 |
| D、用剩的药品应收集起来放回指定的回收处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y |
| Z | W |
| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径小 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
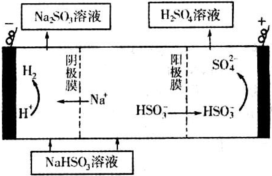 某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.
某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸.| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H216O中,质量数之和是质子数之和的两倍 |
| B、在纯水中加入少量铵盐不会对水的电离产生影响 |
| C、100℃时,纯水的pH=7 |
D、H2O的电子式为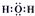 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com