
【题目】已知酸性:H2SO4>![]() >H2CO3>
>H2CO3>![]() > HCO3—,综合考虑反应物的转化率和原料成本等因素,将
> HCO3—,综合考虑反应物的转化率和原料成本等因素,将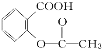 转变为
转变为![]() 的方法有
的方法有
A. 与足量的NaOH溶液共热后,再加入适量H2SO4
B. 与足量的NaOH溶液共热后,再通入足量CO2
C. 与稀H2SO4共热后,加入足量的NaHCO3溶液
D. 与稀H2SO4共热后,加入足量的Na2CO3溶液
【答案】B
【解析】
根据羧酸、酯、酚的性质,结合“强酸制弱酸”或“弱酸制更弱酸”的原理分析。
A. ![]() 在足量NaOH溶液中共热生成的有机物是
在足量NaOH溶液中共热生成的有机物是![]() 和CH3COONa,因H2SO4的酸性比苯甲酸、苯酚酸性都强,所以再加入适量H2SO4时将生成
和CH3COONa,因H2SO4的酸性比苯甲酸、苯酚酸性都强,所以再加入适量H2SO4时将生成![]() ,不能得到
,不能得到![]() ,A项错误;
,A项错误;
B. ![]() 在足量NaOH溶液中共热生成的有机物是
在足量NaOH溶液中共热生成的有机物是![]() 和CH3COONa,因为H2CO3的酸性比苯酚强,但比苯甲酸弱,所以再通入足量CO2时生成
和CH3COONa,因为H2CO3的酸性比苯酚强,但比苯甲酸弱,所以再通入足量CO2时生成![]() ,B项正确;
,B项正确;
C. ![]() 与稀H2SO4共热后生成有机物
与稀H2SO4共热后生成有机物![]() 和CH3COOH,因为苯酚的酸性比H2CO3弱,苯甲酸的酸性比H2CO3强,所以再加入足量NaHCO3溶液时生成
和CH3COOH,因为苯酚的酸性比H2CO3弱,苯甲酸的酸性比H2CO3强,所以再加入足量NaHCO3溶液时生成![]() ,但
,但![]() 与稀H2SO4共热的反应是可逆反应,反应物转化率不高,C项错误;
与稀H2SO4共热的反应是可逆反应,反应物转化率不高,C项错误;
D. ![]() 与稀H2SO4共热后生成有机物
与稀H2SO4共热后生成有机物![]() 和CH3COOH,因为苯酚的酸性比HCO3-强,苯甲酸的酸性比H2CO3强,所以再加入足量Na2CO3溶液时生成
和CH3COOH,因为苯酚的酸性比HCO3-强,苯甲酸的酸性比H2CO3强,所以再加入足量Na2CO3溶液时生成![]() ,不能得到
,不能得到![]() ,D项错误;答案选B。
,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是( )
A.所得溶液中溶质的物质的量浓度为1.0mol·L-1
B.剩余气体中氮元素与氧元素的质量为7∶8
C.原混合气体中NO2和NO的体积比为1∶1
D.反应过程中转移的电子总数为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
①干冰与CO2; ②白磷与红磷; ③![]() Cl与
Cl与![]() Cl;
Cl;
④液氯与氯水; ⑤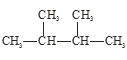 与
与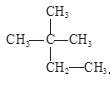 。
。
在上述各组物质中:
(1)互为同位素的是_____________;
(2)互为同素异形体的是__________,
(3)互为同分异构体的是_________;
(4)属于同种物质的是_________。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是_________。
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为_______(用相应的元素符号表示);氮原子的杂化轨道类型为________。

(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______FeO(填“>”“<”或“=”),原因是_________。
(5)NiAs的晶胞结构如图所示:①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为________cm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及CS2、COS等有机硫,煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标,脱除煤气中H2S的方法有干法脱硫和湿法脱硫,其中湿法脱硫的原理是利用Na2CO3溶液吸收H2S生成NaHS,再进一步被空气氧化成Na2S2O3。
请回答下列问题:
(1)①Na2S2O3的化学名称为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为___________________;增大压强,COS的转化率_____________(填“提高”、“不变”或“降低”)。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S |
|
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,在相同的时间内测得不同温度下COS的转化率(未达平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,在相同的时间内测得不同温度下COS的转化率(未达平衡)如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。


由图1可知,催化剂活性最大时对应的温度约为_______;由图2可知,P点时平衡常数K=____________(保留2位有效数字)。
(3)回收处理燃煤烟气中SO2的方法之一是用氨水先将SO2转化为NH4HSO3,再通入空气将其氧化成(NH4)2SO4。能提高燃煤烟气中SO2去除率的措施有__________(填字母)。
a.增大氨水浓度 b.增大燃煤烟气的流速 c.升高温度 d.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-a kJ.mol-1(a>0)。下列说法不正确的是
3Z(g) △H=-a kJ.mol-1(a>0)。下列说法不正确的是
A. 升高反应温度,逆反应速率增大,正反应速率增大
B. 达到化学平衡状态时,X、Y、Z的质量不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达akJ
D. X和Y充分反应生成Z的物质的量不可能达到3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。关于常温下pH=2的H2C2O4溶液,下列说法正确的是( )
A. 1L溶液中的H+数目为0.02NA
B. 加入NaHC2O4固体,溶液酸性增强
C. c(H+)-c(OH-)=c(HC2O4-)+2c(C2O42-)
D. 加水稀释,溶液中所有离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )
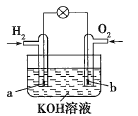
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com