
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
 MnCl2 + Cl2 ↑+ 2H2O (2分)
MnCl2 + Cl2 ↑+ 2H2O (2分) MnCl2 + Cl2 ↑+ 2H2O。
MnCl2 + Cl2 ↑+ 2H2O。

科目:高中化学 来源:不详 题型:单选题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | c | | d | |
| 3 | a | b | | | | e | f |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H3YO4 | B.H4YO4 | C.HYO2 | D.H2YO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.②③④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
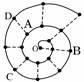
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
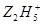 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,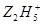 +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com