
【题目】分析、归纳、探究是学习化学的重要方法和手段之一。下面就电解质A回答有关问题(假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a。
①试说明HnB的酸性强弱____。
②当a=10时,A溶液呈碱性的原因是(用离子方程式表示)______。
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为____,(OH-)-c(HB)=______。
④当n=1、c=0.1、溶液中c(HB):c(B-)=1∶99时,A溶液的pH为___(保留整数值)。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρg/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=___。
【答案】当a=7时,HnB为强酸,当a>7时,HnB为弱酸 Bn-+H2O![]() HB(n-1)-+OH- c(Na+)> c(Bn-)> c(OH-)> c(H+) 10-10mol/L 11 (m/n)mcm+n
HB(n-1)-+OH- c(Na+)> c(Bn-)> c(OH-)> c(H+) 10-10mol/L 11 (m/n)mcm+n
【解析】
(1)①依据盐溶液pH分析判断对应酸碱的强弱,弱离子水解盐溶液显示了酸碱性;
②依据盐类水解的实质分析书写离子方程式;
③根据溶液中的pH、电荷守恒、物料守恒、盐的水解原理进行分析、计算、比较离子浓度大小;
④根据c(HB):c(B-)=1:99计算出水解生成氢氧根离子的浓度,再根据水的离子积计算出溶液中氢离子的浓度,然后计算pH;
(2)根据电解质A的化学式写出溶解平衡,根据溶度积常数表达式及题数中数据 计算出该难溶物XnYm的溶度积常数为Ksp。
(1)①电解质A的化学式为NanB,测得浓度为cmol·L-1的A溶液的pH=a.当a=7说明是强酸强碱盐,HnB为强酸,当a大于7,NanB为强碱弱酸盐,在溶液中发生了水解:Bn-+H2O![]() HB(n-1)-+OH-,HnB为弱酸;
HB(n-1)-+OH-,HnB为弱酸;
②NanB溶液的pH=10,NanB为强碱弱酸盐,在溶液中发生了水解:Bn-+H2O![]() HB(n-1)-+OH-;
HB(n-1)-+OH-;
③当a=10,n=1时,由于B-离子水解,溶液呈碱性,溶液中B-离子浓度减小,小于溶液中钠离子的浓度,水解是少量的,所以A溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(B-)>c(OH-)>c(H+)。溶液中存在电荷守恒:c(B-)+c(OH-)=c(H+)+c(Na+);物料守恒:c(Na+)=c(HB)+c(B-);将钠离子浓度带入电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(HB)+c(B-),c(OH-)-c(HB)=c(H+)=1×10-10mol·L-1;
③当n=1、c=0.1,溶液中c(HB):c(B-)=1:99时,参与水解的B-离子为1%,水解生成OH-浓度为:0.1mol·L-1×1%=0.001mol·L-1,则![]() ,所以溶液的pH为11;
,所以溶液的pH为11;
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρg·cm-3,Xm+离子的浓度为cmol·L-1,XnYm的溶解平衡为:XnYm(s)![]() nXm+(aq)+mYn-(aq)),Xm+离子的浓度为cmol·L-1,Yn-的浓度为
nXm+(aq)+mYn-(aq)),Xm+离子的浓度为cmol·L-1,Yn-的浓度为![]() mol·L-1,
mol·L-1,![]() 。
。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】抗肿瘤药物7–氟喹啉衍生物的前体Q的合成路线如下:
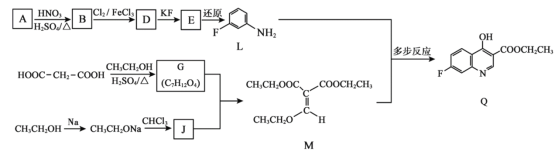
已知:R1ONa+R2C1→R1OR2+NaCl(R1、R2代表烃基)
(1)A属于芳香烃,A的名称是_______。
(2)B→D的化学方程式是_______。
(3)D→E的反应类型是_______。
(4)G的结构简式是_______。
(5)下列关于M的说法正确的是_______(填序号)。
a.M含有两种不同的官能团 b.M存在顺反异构体
c.M和G能用Br2的CCl4溶液鉴别 d.M能与NaOH溶液反应
(6)已知:G + J → M + 2CH3CH2OH。J的结构简式是_________。
(7)L与M反应生成Q的过程如下:

已知:上述异构化反应中,只存在氢原子和不饱和键的位置变化。Y的分子中含有两个六元环。Y的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
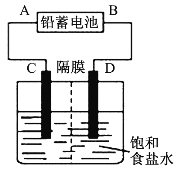
铅蓄电池充、放电时的电池反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
(1)铅蓄电池放电时的正极反应为___。
(2)请写出电解饱和食盐水的化学方程式:____。
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明铅蓄电池的A极为___极。
(4)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g·cm-3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子____mol。
②若铅蓄电池消耗2molH2SO4,则可收集到H2的体积(标准状况下)为___L。
③若蓄电池消耗amol硫酸,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气和氢气全部排出)___(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是

A. 冰表面第一层中,HCl以分子形式存在
B. 冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
C. 冰表面第三层中,冰的氢键网格结构保持不变
D. 冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.224mLB.168mLC.336mLD.448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
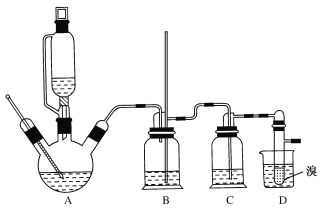
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钪(Sc2O3)在合金、电光源、催化剂、激活剂和陶瓷等领域有广泛的应用,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下:
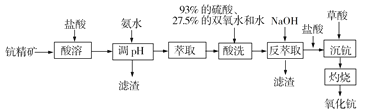
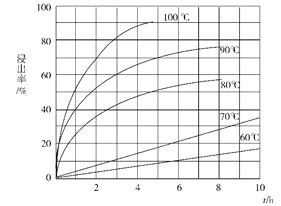
(1)“酸溶”步骤中,钪的浸出率结果如图所示。由图可知,为使钪的浸出率达90%左右,所采用的生产条件为___________________。
(2)加入氨水调节pH=3,过滤,滤渣主要成分是_____________;若再向滤液加入氨水调节pH=6,滤液中 Sc3+能否沉淀完全(离子浓度小于105 mol/L)?______________(列式计算并作判断)。(25℃时,Ksp[Mn(OH)2]=1.9×1013、Ksp[Fe(OH)3]=2.6×1039,Ksp[Sc(OH)3]=9.0×1031)
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式______________。
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时pH=2的草酸溶液中![]() =_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
=_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
(5)草酸钪“灼烧”的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
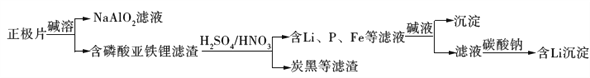
下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com