
【题目】氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= a kJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是_______(填标号)。
A 反应速率 B 反应热 C 活化能 D 生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+ (aq)=2Fe2+ (aq) +O2(g) +2H+ (aq)ΔH=b kJ·mol-1
第二步反应的热化学方程式为____________。
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g) ![]() 2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4 molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

①该反应的速率v = k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是____________(填标号)。
A 使用催化剂,k不变
B 温度升高,k增大
C 平衡后分离出水蒸气,k变小
D 平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1________T2(填“>”或“<”)。该反应的ΔH______0(填“>”或“<”),判断的依据是_________。
③T2时,HCl的平衡转化率=________,反应的Kx=_____(Kx为以物质的量分数表示的平衡常数)。
【答案】BD H2O2(aq) +2Fe2+(aq) +2H+(aq)=2Fe3+(aq)+2H2O(l) ΔH= (a-b) kJ·mol-1 BD < < T1、T2的平衡体系中气体减少量分别为n(T1)=![]() =0.625mol; n(T2)=
=0.625mol; n(T2)= ![]() =0.5mol,所以T1平衡时转化率更大 50%
=0.5mol,所以T1平衡时转化率更大 50% ![]()
【解析】
(1)①催化剂参与了化学反应,改变了反应历程(生成不同的中间产物),降低了活化能,从而能使化学反应速率加快,但是催化剂的质量和性质不变,反应热不变(只与始终态有关);
②Fe3+作为催化剂,在反应前后质量和性质不变,根据盖斯定律总反应=第一步反应+第二步反应;
(2)①A.催化剂降低了反应的活化能,使反应的速率常数k增大;
B.温度改变瞬间,浓度没有影响,即通过增大k从而改变了速率;
C.从速率方程可知,平衡后分离出水蒸气,降低了c(H2O),使平衡正向移动,从而改变了c(O2)和c(HCl);
D.化学平衡的建立与途径无关,所以“平衡后再充入1molO2和4molHCl”,相当于增大反应体系的压强;
②从图象可知,T2温度下,容器中压强大,达到平衡所需要的时间短,所以温度T2>T1;T1、T2温度下,气体物质的量的减少量分别为n(T1)=5×![]() =0.625mol、n(T2)=5×
=0.625mol、n(T2)=5×![]() =0.5mol,即T1平衡时转化率更大,且因为T2>T1,所以△H<0;
=0.5mol,即T1平衡时转化率更大,且因为T2>T1,所以△H<0;
③对于气相反应,经验平衡常数常见的有Kc、Kp、Kx等,三种平衡常数的表示式相似,只是Kc、Kp、Kx分别用平衡时物质的量浓度、分压、物质的量分数表示。

以此计算HCl的平衡转化率及Kx。
(1)①根据过渡态理论,催化剂参与了化学反应,改变了反应历程(生成不同的中间产物),降低了活化能,从而能使化学反应速率加快,但是催化剂的质量和性质不变,反应热不变(只与始终态有关),BD正确,故答案为:BD;
②Fe3+作为催化剂,在反应前后质量和性质不变,根据盖斯定律总反应=第一步反应+第二步反应,故第二步反应为H2O2(aq)+2Fe2+(aq)+2H+(aq)=2Fe3+(aq)+2H2O(l) △H=(ab)kJmol1,
故答案为:H2O2(aq)+2Fe2+(aq)+2H+(aq)=2Fe3+(aq)+2H2O(l) △H=(ab)kJmol1;
(2)①A.催化剂降低了反应的活化能,使反应的速率常数k增大,根据速率方程v=kca(O2)cb(HCl),反应速率随之增大,A错误;
B. 温度改变瞬间,浓度没有影响,即通过增大k从而改变了速率,使平衡发生移动,故B正确;
C. 从速率方程可知,平衡后分离出水蒸气,降低了c(H2O),使平衡正向移动,从而改变了c(O2)和c(HCl),但对k没有影响,故C错误;
D. 化学平衡的建立与途径无关,所以“平衡后再充入1molO2和4molHCl”,相当于增大反应体系的压强,反应有利于向气体分子数减小的方向进行,故D正确;故答案为:BD;
②从图象可知,T2温度下,容器中压强大,达到平衡所需要的时间短,所以温度T2>T1;T1、T2温度下,气体物质的量的减少量分别为n(T1)=5×![]() =0.625mol、n(T2)=5×
=0.625mol、n(T2)=5×![]() =0.5mol,即T1平衡时转化率更大,且因为T2>T1,所以△H<0,故答案为:<;<;T1、T2的平衡体系中气体减少量分别为n(T1)=5×
=0.5mol,即T1平衡时转化率更大,且因为T2>T1,所以△H<0,故答案为:<;<;T1、T2的平衡体系中气体减少量分别为n(T1)=5×![]() =0.625mol、n(T2)=5×
=0.625mol、n(T2)=5×![]() =0.5mol,所以T1平衡时转化率更大;
=0.5mol,所以T1平衡时转化率更大;
③对于气相反应,经验平衡常数常见的有Kc、Kp、Kx等,三种平衡常数的表示式相似,只是Kc、Kp、Kx分别用平衡时物质的量浓度、分压、物质的量分数表示。

则HCl的平衡转化率为![]() ×100%=50%,
×100%=50%,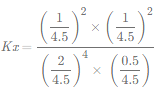 =
=![]() ,故答案为:50%;
,故答案为:50%;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为___。
(2)H2SO4与HClO4中,酸性较强的是___。
(3)NaOH与Al(OH)3中,属于两性氢氧化物的是___。它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
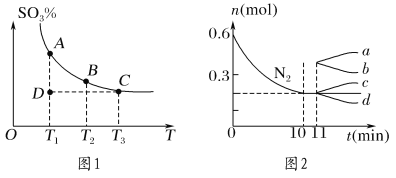
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v逆 ________ (填“>”“<”或“=”)v正。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂 B.增大压强
C.及时分离出氨气 D.升高温度
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用NH3表示0~10 min内该反应的平均速率v(NH3)=______________;从第11 min起,升高温度,则n(N2)的变化曲线为________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组采用电渗析法从含NH4H2PO4 和(NH4)2HPO4的废水中回收NH3·H2O和 H3PO4,装置如图所示。下列说法错误的是( )
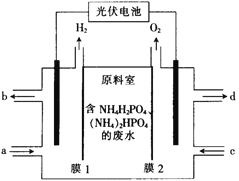
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.a处进入稀氨水,d处流出浓H3PO4溶液
C.阴极区总反应式为2H2O+2NH4++2e-=2NH3·H2O+H2↑
D.每放出11.2L(标准状况)H2时,能回收98gH3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molSO2和1 molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A.SO2与O2的转化率可能相等
B.容器中一定存在n(SO2)>1mol且n(SO3)<2mol
C.放出的热量为197kJ
D.当O2的转化率为50%时SO2和SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①___;
b.若B、C都不是气体,气体的平均相对分子质量②____;
c.若B是气体,C不是气体,气体的平均相对分子质量③___;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④___态,C是⑤___态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系己达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是( )
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.在平衡时体系内N2O4的物质的量为0.25mol
C.在2s时体系内的压强为开始时的1.1倍
D.平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.总反应方程式为2H2+O2═2H2O
C.b极反应是O2+4OH--4e-═2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com