
【题目】有机物G的分子式为C11H12O3,核磁共振氢谱中有5组吸收峰,是制备负性光致抗蚀剂的原料之一,其合成路线如下:
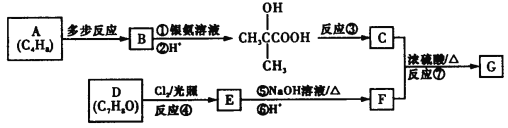
回答下列问题:
(1)E中官能团的名称为__________。
(2)反应③的反应类型为__________。
(3)由C和F生成G的化学方程式为______________________________。
(4)X分子比G少一个CH2原子团,同时满足下列条件的X的结构有__________种。
①能与FeCl3溶液发生显色反应
②能发生银镜反应,且1 mol X可生成4 mol Ag
③核磁共振氢谱中有5组吸收峰
(5)运用自己所学知识,写出A→B的合成路线。_______________
【答案】羟基和氯原子 还原反应 : +
+![]()
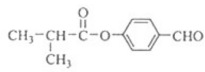
![]() H2O 4 CH2=C(CH3)2
H2O 4 CH2=C(CH3)2![]()
![]()
![]() CH3CCl(CH2Cl)CH3
CH3CCl(CH2Cl)CH3![]() CH3COH(CH2OH)CH3
CH3COH(CH2OH)CH3![]() CH3COH(CHO)CH3
CH3COH(CHO)CH3
【解析】
有机物G的分子式为C11H12O3,核磁共振氢谱中有5组吸收峰,是制备负性光致抗蚀剂的原料之一,所以G的结构简式 ,断酯基为
,断酯基为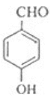 和
和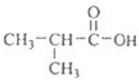 ,所以C的结构简式为
,所以C的结构简式为 ,F的结构简式为
,F的结构简式为![]() ,根据
,根据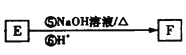 逆推E的结构简式为
逆推E的结构简式为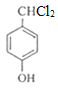 ,以此分析解答本题。
,以此分析解答本题。
(1)由上述可知E的结构简式为 ,所以E中官能团的名称为羟基和氯原子,故答案:羟基和氯原子;
,所以E中官能团的名称为羟基和氯原子,故答案:羟基和氯原子;
(2)由框图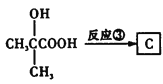 ,且C的结构简式为
,且C的结构简式为 ,所以反应③的反应类型为取代反应,故答案:还原反应;
,所以反应③的反应类型为取代反应,故答案:还原反应;
(3)由C的结构简式为 ,F的结构简式为
,F的结构简式为![]() ,由C和F生成G的化学方程式为:
,由C和F生成G的化学方程式为: +
+![]()

![]() H2O,故答案:
H2O,故答案: +
+![]()
![]()

![]() H2O;
H2O;
(4)由G的结构简式 ,X分子比G少一个CH2原子团,同时满足①能与FeCl3溶液发生显色反应,说明苯环上有羟基,②能发生银镜反应,且1 mol X可生成4 mol Ag,说明含有两个醛基,③核磁共振氢谱中有5组吸收峰的同分异构体由:
,X分子比G少一个CH2原子团,同时满足①能与FeCl3溶液发生显色反应,说明苯环上有羟基,②能发生银镜反应,且1 mol X可生成4 mol Ag,说明含有两个醛基,③核磁共振氢谱中有5组吸收峰的同分异构体由: (两个醛基上移,共2种),
(两个醛基上移,共2种),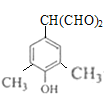 (两个甲基上移共2中),所以共有4种;故答案:4;
(两个甲基上移共2中),所以共有4种;故答案:4;
(5)由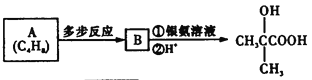 逆推B的结构简式为
逆推B的结构简式为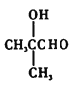 ,A的结构简式为CH2=C(CH3)2,所以A→B的合成路线为:CH2=C(CH3)2
,A的结构简式为CH2=C(CH3)2,所以A→B的合成路线为:CH2=C(CH3)2![]()
![]()
![]() CH3CCl(CH2Cl)CH3
CH3CCl(CH2Cl)CH3![]() CH3COH(CH2OH)CH3
CH3COH(CH2OH)CH3![]() CH3COH(CHO)CH3,所以答案:CH2=C(CH3)2
CH3COH(CHO)CH3,所以答案:CH2=C(CH3)2![]()
![]()
![]() CH3CCl(CH2Cl)CH3
CH3CCl(CH2Cl)CH3![]() CH3COH(CH2OH)CH3
CH3COH(CH2OH)CH3![]() CH3COH(CHO)CH3。
CH3COH(CHO)CH3。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】工业用黄铜矿[主要成分CuFeS2,还含少量锌(Zn)、铅(Pb)的硫化物]冶炼铜的一种方法的流程如下:

(1)过程Ⅰ中发生下列反应:①CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2S;②CuCl + Cl-![]() CuCl2-上述反应中盐酸的作用是________________________。
CuCl2-上述反应中盐酸的作用是________________________。
(2)过程Ⅱ中通入空气,将Fe2+转化FeOOH沉淀,离子方程式是_________________。
(3)Ⅳ中加入Na2CO3溶液的目的是______________________________________。
(4)Ⅴ中反应的离子方程式是______________________________。
(5)秉承绿色化学的理念,请提出在冶炼厂中处理和利用副产品NaCl溶液的方案,并说明理由:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组进行如图实验。欲使溶液红色加深,下列操作或分析正确的是

A.加入少量KCl固体
B.再滴加5~6滴1 mol/L KSCN溶液
C.再滴加3~5滴0.01 mol/L NaOH溶液
D.对溶液降温,也可观察到溶液红色加深,说明反应为:FeCl3+3KSCN![]() Fe(SCN)3+3KCl△H>0
Fe(SCN)3+3KCl△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 铜镁合金完全溶解于
铜镁合金完全溶解于![]() 、密度为
、密度为![]() 、质量分数为
、质量分数为![]() 的浓硝酸中,得到
的浓硝酸中,得到![]() 气体
气体![]() 标准状况
标准状况![]() ,向反应后的溶液中加入适量的
,向反应后的溶液中加入适量的![]() 溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是
溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是![]()
![]()
A.该浓硝酸中HNO3的物质的量浓度是14 mol/L
B.加入NaOH溶液的体积是160 mL
C.起氧化性的硝酸的物质的量为0.16 mol
D.得到的金属氢氧化物的沉淀为6.24 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室设计如下实验研究2Fe3++ 2I-= 2Fe2+ +I2的反应。

(1)振荡静置后C中观察到的现象是____; 为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液然后____ (写出实验操作和现象)。
(2)测定上述KI溶液的浓度,进行以下操作:
I.用移液管移取20.00mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
Ⅱ.小心加热除去过量的H2O2。
Ⅲ.用淀粉做指示剂,用cmol/L Na2S2O3标准溶液滴定,反应原理为:2 Na2S2O3+ I2=2Na1+Na2SO4
①步骤II是否可省略? ____ (答“可以”或“不可以”)
②步骤川达到滴定终点的现象是____。
③已知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用SO2和Cl2在活性炭作用下制取SO2C12,原理为SO2(g)+Cl2(g)SO2Cl2(l) H=-97.3kJ/mol。装置如图所示(部分装置已省略)。已知SO2C12的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是

A.乙中盛放的试剂为无水氯化钙
B.制备过程中需要将装置甲置于冰水浴中
C.用来冷却的水应该从a口入,b口出
D.可用硝酸与亚硫酸钠反应制备二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名化学家徐光宪在稀土化学等领域取得了卓越成就,被誉为“稀土界的袁隆平”。稀土元素包括钪、钇和镧系元素。请回答下列问题:
(1)写出基态二价钪离子(Sc2+)的核外电子排布式____,其中电子占据的轨道数为 ____。
(2)在用重量法测定镧系元素和使镧系元素分离时,总是使之先转换成草酸盐,然后经过灼烧而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3nH2O+6HCl。
①H2C2O4中碳原子的杂化轨道类型为____;1 mol H2C2O4分子中含σ键和π键的数目之比为 ___。
②H2O的VSEPR模型为 ___;写出与H2O互为等电子体的一种阴离子的化学式_______。
③HCI和H2O可以形成相对稳定的水合氢离子盐晶体,如HCl2H2O,HCl2H2O中含有H5O2+,结构为![]() ,在该离子中,存在的作用力有___________
,在该离子中,存在的作用力有___________
a.配位键 b.极性键 c.非极性键 d.离子键 e.金属键 f氢键 g.范德华力 h.π键 i.σ键
(3)表中列出了核电荷数为21~25的元素的最高正化合价:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
(4)PrO2(二氧化镨)的晶胞结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。假设相距最近的Pr原子与O原子之间的距离为a pm,则该晶体的密度为_____gcm-3(用NA表示阿伏加德罗常数的值,不必计算出结果)。
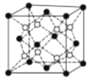
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
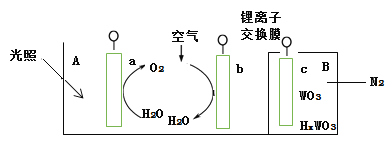
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com