
����Ŀ��ij��ȤС����ʵ�����������ʵ���о�2Fe3++ 2I-= 2Fe2+ +I2�ķ�Ӧ��

(1)���ú�C�й۲쵽��������____�� Ϊ֤���÷�Ӧ����һ���ȣ���Ӧ����ʵ��Ϊ��ȡC�з�Һ����ϲ���ҺȻ��____ (д��ʵ�����������)��
(2)�ⶨ����KI��Һ��Ũ�ȣ��������²�����
I.����Һ����ȡ20.00mL KI��Һ����ƿ�У���������ϡ�����ữ���ټ�������H2O2��Һ����ַ�Ӧ��
��.С�ļ��ȳ�ȥ������H2O2��
��.�õ�����ָʾ������cmol/L Na2S2O3����Һ�ζ�����Ӧԭ��Ϊ��2 Na2S2O3+ I2=2Na1+Na2SO4
�ٲ���II�Ƿ��ʡ��? ____ (����������������������)
�ڲ��质�ﵽ�ζ��յ��������____��
����֪I2Ũ�Ⱥܸ�ʱ����������γ��ȶ��İ����ﲻ���룬Ϊ��������ʵ������ָʾ�������ʱ����____��
���𰸡���Һ�ֲ㣬�²����Ȼ�̼�����ɫ���ϲ�ˮ��Ϊ����ɫ �μ� KSCN��Һ����Һ��� ������ ���μ����һ��Na2S2O3����Һʱ����ɫ��ȥ��30���ڲ��ָ� ��c mol/L Na2S2O3����Һ�ζ�����Һ��dz��ɫʱ���������ָʾ�����ټ����μ�
��������
(1).�������֪�������ĵ⻯����Һ���Ȼ�����Һ��Ӧ�����Ȼ������͵⣬����Һ�м������Ȼ�̼�����ã���Һ�ֲ�Ϊ֤���÷�Ӧ����һ���ȣ�Ӧ�����ϲ���Һ���Ƿ����Fe3+��
(2).�ɲ����֪��˫��ˮ��������ǿ�ڵ��ʵ⣬������1ʡ�ԣ���Һ�й����������Na2S2O3��Һ��Ӧ����Na2S2O3����Һ����ʱ����Һ�еⵥ����ȫ��Ӧ����Һ����ɫ��Ϊ��ɫ��Ϊ��������ʵ�����ζ���ʼʱ���ܼ������ָʾ����Ӧ����I2Ũ�Ƚ�Сʱ�ٵ�����ۡ�
(1).�������֪�������ĵ⻯����Һ���Ȼ�����Һ��Ӧ�����Ȼ������͵⣬����Һ�м������Ȼ�̼�����ã���Һ�ֲ㣬�ϲ�Ϊ�Ȼ������Ȼ������û����Һ����Һ����ɫΪ����ɫ���²�Ϊ������Ȼ�̼��Һ����Һ����ɫΪ��ɫ��Ϊ֤���÷�Ӧ����һ���ȣ�Ӧ�����ϲ���Һ���Ƿ����Fe3+����Ӧ����ʵ��Ϊ��ȡC�з�Һ����ϲ���Һ��Ȼ��μ�KSCN��Һ����Һ���ɫ���ʴ�Ϊ����Һ�ֲ㣬���²����Ȼ�̼�����ɫ���ϲ�ˮ��Ϊ����ɫ���μ�KSCN��Һ����Һ��죻
(2).�ɲ����֪��˫��ˮ��������ǿ�ڵ��ʵ⣬������1ʡ�ԣ���Һ�й����������Na2S2O3��Һ��Ӧ������Na2S2O3����Һ���ƫ��������ƫ�ߣ��ʲ���ʡ�ԣ���Na2S2O3����Һ����ʱ����Һ�еⵥ����ȫ��Ӧ����Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ԭ����I2Ũ�Ⱥܸ�ʱ����������γ��ȶ��İ����ﲻ���룬Ϊ��������ʵ�����ζ���ʼʱ���ܼ������ָʾ����Ӧ����I2Ũ�Ƚ�Сʱ�ٵ�����ۣ��ʴ�Ϊ�����ܣ����������һ��Na2S2O3����Һʱ����ɫ��ȥ��30���ڲ���ԭ����c mol/L Na2S2O3����Һ�ζ�����Һ��dz��ɫʱ���������ָʾ�����ټ����μӡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ K2[Cu(C2O4)2]��2H2O(M=354g/mol)������ȷ��ȡ����1.000g���� NH3��H2O�У�����ˮ������250mL��ȡ������Һ25.00mL����ƿ�У��ټ���10mL 3.000mol/L��H2SO4��Һ����0.01000mol/L��KMnO4��Һ�ζ����ظ����飬ƽ������ KMnO4��Һ20.00mL����֪��C2O42-���������±�MnO4-����ΪCO2�����ʲ��μӷ�Ӧ������Ʒ��K2[Cu(C2O4)2]��2H2O����������Ϊ____________(����С�������λ) ��д����Ҫ������̣�__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�����ľ����ܱ������з�����Ӧ��N2(g)��3H2(g)![]() 2NH3(g) ��H<0�����в���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����
2NH3(g) ��H<0�����в���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����
A.���������ܶȲ���B.��ϵ�¶Ȳ���
C.3v��(NH3)��2v��(H2)D.N2��NH3��Ũ�ȵı�ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������AgCl��Ag2CrO4���ܶȻ��ɵõ���ͼ��������Һ��Cl����������ʹ��AgNO3��Һ�ζ���Na2CrO4��ָʾ�������б����������
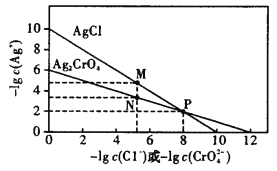
A.��ͼ��֪��Ag2CrO4���ܶȻ�С��AgCl���ܶȻ�
B.��ͼ��֪����Cl���ĵζ�ָʾ��ʱ��Na2CrO4��Ũ�Ȳ��ܹ���
C.��ͼ��֪��ֻ�е�c��Ag������10��2mol��L��1ʱ��![]() �ȳ���
�ȳ���
D.������AgNO3��Һ�ζ�������Һ��I����������Ϊ���ɵ�AgI������������I����ʹ�ζ��յ���ǰ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ᣨH3PO3��Ϊ��Ԫ���ᣬ25��ʱ����Na2HPO3��Һ�е������ᣬ�����Һ�е��й�����Ũ��֮�ȵĶ�������ҺpH�Ĺ�ϵ��ͼ��ʾ������������ȷ����

A.M��W�������ڵ�ֱ�߱�ʾpH��![]() �ı仯��ϵ
�ı仯��ϵ
B.����Һ������ʱ�����ܴ��ڣ�c��Na������c��![]() ����2c��
����2c��![]() ��
��
C.ͼ��N���ʾ�����HCl�����ʵ�����ԭ��Һ��Na2HPO3���ʵ������
D.25��ʱ��![]() ��H2O
��H2O![]()
![]() ��OH����ƽ�ⳣ��Ϊ1��0��10��12.57
��OH����ƽ�ⳣ��Ϊ1��0��10��12.57
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���G�ķ���ʽΪC11H12O3���˴Ź�����������5�����շ壬���Ʊ����Թ��¿�ʴ����ԭ��֮һ����ϳ�·�����£�
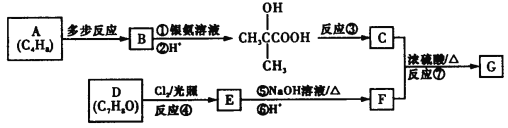
�ش��������⣺
��1��E�й����ŵ�����Ϊ__________��
��2����Ӧ�۵ķ�Ӧ����Ϊ__________��
��3����C��F����G�Ļ�ѧ����ʽΪ______________________________��
��4��X���ӱ�G��һ��CH2ԭ���ţ�ͬʱ��������������X�Ľṹ��__________�֡�
������FeCl3��Һ������ɫ��Ӧ
���ܷ���������Ӧ����1 mol X������4 mol Ag
�ۺ˴Ź�����������5�����շ�
��5�������Լ���ѧ֪ʶ��д��A��B�ĺϳ�·�ߡ�_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽������ͭ���仯��������ʣ�ijͬѧ��Ʋ���������������ʵ�顣
ʵ��һ��
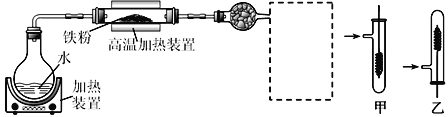
(1)д���ڸ��¼���װ���з����ķ�Ӧ�Ļ�ѧ����ʽ___________
(2)���߿���ѡ���װ����_____(����������������)��ʵ��ʱӦ�Ƚ�����״ͭ˿���ȣ���ں��ٳ���Ѹ���������ƵõĴ��������У��۲쵽��ʵ��������_________________��
(3)ʵ���Ϊ����Ӳ�ʲ������еĹ����Ƿ�+3�۵���Ԫ�أ���ͬѧȡһ�����Ĺ��岢��һ��Ũ�ȵ������ܽ⣬�μ�_________��Һ(���Լ����ƻ�ѧʽ)��û�г���Ѫ��ɫ��˵���ù�����û��+3�۵���Ԫ�ء������жϸ�ͬѧ�Ľ����Ƿ���ȷ��˵������________
ʵ������̷��Ǻ���һ�����ᾧˮ������������Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ������(�����˿���![]() ��
��![]() ����Ϊװ��A)���أ���Ϊm1g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊm2g��BΪ����ܡ���ͼ���Ӻ�װ�ý���ʵ�顣
����Ϊװ��A)���أ���Ϊm1g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊm2g��BΪ����ܡ���ͼ���Ӻ�װ�ý���ʵ�顣

ʵ�鲽�����£�(1)_______��(2)��ȼ�ƾ��ƣ����ȣ�(3)________��(4)_______��(5)________��(6)����A���ظ������������裬ֱ��A���أ���Ϊm3g��
(4)�뽫����ʵ�鲽��ı����д�ڶ�Ӧ����ĺ����ϡ�
a. �ر�![]() ��
��![]() b. Ϩ��ƾ��� c. ��
b. Ϩ��ƾ��� c. ��![]() ��
��![]() ����ͨ��
����ͨ��![]() d. ��ȴ������
d. ��ȴ������
(5)����Ҫ���к��ز�����ԭ����_______________��
(6)��֪������ʵ�������£��̷�����ֻ��ʧȥ�ᾧˮ������������������ֽ⣬����ʵ���¼�������̷���ѧʽ�нᾧˮ��ĿX=____________(�ú�m1��m2��m3����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������ý���ϣ���Ҫ�ɷ�ΪNi-Al�Ͻ𣬻�������Fe��Cu��Zn���л�� �Ʊ�NiO�����ս�����Դ������������ʾ��

��֪������������1�ͱ�2��ʾ
��1�������ܵ���ʵ��ܶȻ�������25�棩
���� | Ksp | ���� | Ksp |
Fe(OH)3 | 4.0��10-38 | CuS | 6.3��10-34 |
Fe(OH)2 | 1.8��10-16 | ZnS | 1.6��10-24 |
Al(OH)3 | 1.0��10-33 | NiS | 3.2��10-18 |
Ni(OH)2 | 2.0��10-15 |
��2 ԭ�ϼ۸��
���� | �۸�/��Ԫ��-1�� |
ƯҺ����25.2%NaClO�� | 450 |
˫��ˮ����30%H2O2�� | 2400 |
�ռ��98%NaOH�� | 2100 |
�����99.5%Na2CO3�� | 600 |
��ش��������⣺
��1�������ա���Ŀ����________________________________��
��2�����Լ�a��������Ϊ__________________��ѡ����Լ���������______��
��3����������ʱ��Ӧ�����ӷ���ʽΪ__________________________________________��
��4����ʹ��Һ��Fe3+��A13+��Ũ�Ⱦ�С�ڵ���1.0��10-6 mol L-1���衰����pH������Ϊ_______________��
��5�����Լ�b��Ӧѡ��__________������ˮ��С�ʱ����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��6�����������һ��Ӧ�ù㷺�Ķ��ε�أ��ŵ�ʱ���õ�ص��ܷ�ӦΪNiOOH+MH=Ni(OH)2+M��������������2 mol����ʱ�������ϸ�����������__________g�����ʱ��������ӦʽΪ_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.20 mol/LKMnO4������Һ 0.l0L��һ����pH=3.0�IJ���(HOOC-COOH)��Һ��ϣ��ų�VL���塣NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.9 g HOOC-COOH�����õ��Ӷ���ĿΪ0.9NA
B.��0.01mol KMnO4 ����ԭʱ��ǿ���ṩ��H+��ĿΪ 0.01NA
C.pH=3.0�IJ�����Һ����H+��ĿΪ0.001NA
D.�÷�Ӧ�ͷ� CO2������ĿΪVNA/22.4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com