
【题目】为测定 K2[Cu(C2O4)2]·2H2O(M=354g/mol)含量,准确称取试样1.000g溶于 NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入10mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,重复试验,平均消耗 KMnO4标准液20.00mL。已知:C2O42-酸性条件下被MnO4-氧化为CO2,杂质不参加反应。该样品中K2[Cu(C2O4)2]·2H2O的质量分数为____________(保留小数点后两位) ,写出简要计算过程:__________________。
【答案】88.50% 根据电子得失新的可得关系式:4KMnO4~5K2[Cu(C2O4)2]2H2O,n(KMnO4)总=c·V= 0.01000 mol/L×0.02 L×![]() =2.0×10-3 mol,可得=n(K2[Cu(C2O4)2]·2H2O)=
=2.0×10-3 mol,可得=n(K2[Cu(C2O4)2]·2H2O)=![]() n(KMnO4)总=2.5×10-3 mol,m(K2[Cu(C2O4)2]·2H2O)=0.885 g,则该样品中K2[Cu(C2O4)2]·2H2O的质量分数为
n(KMnO4)总=2.5×10-3 mol,m(K2[Cu(C2O4)2]·2H2O)=0.885 g,则该样品中K2[Cu(C2O4)2]·2H2O的质量分数为![]() ×100%=88.50%
×100%=88.50%
【解析】
根据K2[Cu(C2O4)2]·2H2O具有还原性,而KMnO4具有氧化性,二者发生氧化还原反应,根据电子守恒,利用KMnO4的物质的量计算出样品中K2[Cu(C2O4)2]·2H2O的物质的量及质量,结合质量分数的含义计算其质量分数。
根据氧化还原反应中电子得失数目相等,可知K2[Cu(C2O4)2]·2H2O与KMnO4的物质的量关系式为:5K2[Cu(C2O4)2]·2H2O~4KMnO4,25.00mL K2[Cu(C2O4)2]·2H2O配成的溶液消耗KMnO4的物质的量为n(KMnO4)=c·V=0.01000mol/L×0.02 L=2.0×10-4mol,则250 mL这种溶液消耗KMnO4的总物质的量为n(KMnO4)总=2.0×10-4mol×![]() =2.0×10-3mol,则根据二者反应关系可知K2[Cu(C2O4)2]·2H2O的物质的量为n(K2[Cu(C2O4)2]·2H2O)=
=2.0×10-3mol,则根据二者反应关系可知K2[Cu(C2O4)2]·2H2O的物质的量为n(K2[Cu(C2O4)2]·2H2O)=![]() n(KMnO4)总=
n(KMnO4)总=![]() ×2.0×10-3mol=2.5×10-3mol,其质量为m(K2[Cu(C2O4)2]·2H2O)=n·M=2.5×10-3mol×354g/mol=0.885g,所以该样品中K2[Cu(C2O4)2]·2H2O的质量分数为
×2.0×10-3mol=2.5×10-3mol,其质量为m(K2[Cu(C2O4)2]·2H2O)=n·M=2.5×10-3mol×354g/mol=0.885g,所以该样品中K2[Cu(C2O4)2]·2H2O的质量分数为![]() ×100%=88.50%。
×100%=88.50%。


科目:高中化学 来源: 题型:
【题目】萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是 ( )
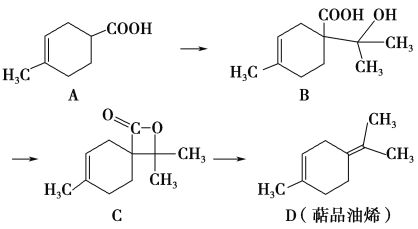
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 1 mol有机物A中含有1.204×1024个双键
D. 有机物C的同分异构体中不可能有芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图:
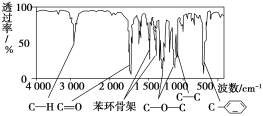
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的分子式为________。
(2)A的结构简式为_______________________________________________(写一种即可)。
(3)A的芳香化合物类同分异构体有多种,其中分子中不含甲基的芳香酸为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 0.1mol/L的H2A溶液中滴加0.1mol/LNaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是
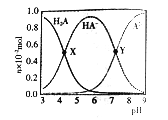
A. H2A在水中的电离方程式是:H2A=H++HA-, HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. Y点溶液中存在以下关系: c(H+)+c(Na+)=c(OH-)+3c(HA-)
D. X点溶液中含A元素相关微粒:c(H2A)+c(HA-)+c(A2-)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③ ④
④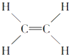 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的是⑤⑦⑧⑨
C. 属于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业用黄铜矿[主要成分CuFeS2,还含少量锌(Zn)、铅(Pb)的硫化物]冶炼铜的一种方法的流程如下:

(1)过程Ⅰ中发生下列反应:①CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2S;②CuCl + Cl-![]() CuCl2-上述反应中盐酸的作用是________________________。
CuCl2-上述反应中盐酸的作用是________________________。
(2)过程Ⅱ中通入空气,将Fe2+转化FeOOH沉淀,离子方程式是_________________。
(3)Ⅳ中加入Na2CO3溶液的目的是______________________________________。
(4)Ⅴ中反应的离子方程式是______________________________。
(5)秉承绿色化学的理念,请提出在冶炼厂中处理和利用副产品NaCl溶液的方案,并说明理由:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“奥司他韦”是化学家们合成的药品,能抗病毒,用于治疗流感。于2001年在我国投入使用。其合成路线如下

已知: +H2O
+H2O
(1)莽草酸的含氧官能团名称有:__________,反应③的反应类型:_________。
(2)反应①的反应试剂和反应条件:_____________________ 。
(3)请写出反应②的化学方程式:____________________________________ 。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有_____种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有_____个手性碳。
(6)设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线_________________
的合成路线_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室设计如下实验研究2Fe3++ 2I-= 2Fe2+ +I2的反应。

(1)振荡静置后C中观察到的现象是____; 为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液然后____ (写出实验操作和现象)。
(2)测定上述KI溶液的浓度,进行以下操作:
I.用移液管移取20.00mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
Ⅱ.小心加热除去过量的H2O2。
Ⅲ.用淀粉做指示剂,用cmol/L Na2S2O3标准溶液滴定,反应原理为:2 Na2S2O3+ I2=2Na1+Na2SO4
①步骤II是否可省略? ____ (答“可以”或“不可以”)
②步骤川达到滴定终点的现象是____。
③已知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com