
【题目】某实验小组研究温度对化学反应H2(g)+I2(g)![]() 2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
时间 | 0 | 20 | 40 | 60 | 80 | 100 | |
HI(g)的物质 的量分数 | T1 | 0 | 0.50 | 0.68 | 0.76 | 0.80 | 0.80 |
T2 | 0 | 0.60 | 0.72 | 0.75 | 0.75 | 0.75 | |
下列说法正确的是( )
A.T1温度下,0~20min之间,H2的平均反应速率为0.025mol·L-1·min-1
B.在T1温度下,该反应有可能在70min时已达到平衡状态
C.T2温度下,20min时的正反应速率大于40min时的逆反应速率
D.由表中数据可知,温度越高,H2(g)与I2(g)的反应限度越大
【答案】C
【解析】
T1温度下,80min到100min,HI(g)的物质的量分数不再变化,说明80min时已平衡;
T2温度下,60min到80min,HI(g)的物质的量分数不再变化,说明60min时已平衡。
A.设H2的变化值为xmol,则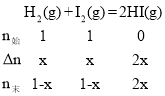 ,T1温度下,20min时,HI(g)的物质的量分数为50%,则50%=
,T1温度下,20min时,HI(g)的物质的量分数为50%,则50%=![]() ,解得:x=0.5,故T1温度下,0~20min之间,v(H2)=
,解得:x=0.5,故T1温度下,0~20min之间,v(H2)=![]() = 0.0125mol·L-1·min-1,A错误;
= 0.0125mol·L-1·min-1,A错误;
B.由表可知,T1温度下,40min到60min,HI(g)的物质的量分数增大0.76-0.68=0.08,平均每10min增大0.04,随着反应的进行,60min到70min,反应速率减小,则60min到70min,HI(g)的物质的量分数增大值小于0.04,即70min,HI(g)的物质的量分数小于0.76+0.04=0.8,故70min时,反应还未平衡,B错误;
C.随着反应的进行,正反应速率减小,故T2温度下,20min时的正反应速率大于40min时的逆反应速率,C正确;
D.T2温度达到平衡的时间比T1温度时短,说明T2>T1,由表可知,T2时H2(g)与I2(g)的反应限度小于T1时H2(g)与I2(g)的反应限度,故温度越高,H2(g)与I2(g)的反应限度越小,D错误。
答案选C。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图。

(1)O点导电能力为零的理由: 。
(2)a、b、c三点酸性由大到小的顺序为 。
(3)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选 。
A.加热
B.加很稀的NaOH溶液
C.加固体KOH
D.加水
E.加固体CH3COONa
F.加Zn粒
(4)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是 。
A.c(H+) B.H+个数
C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:
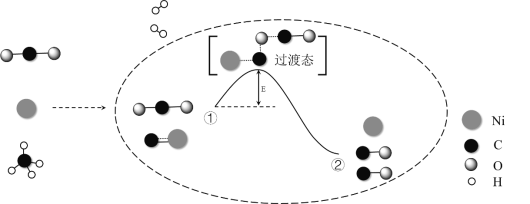
下列说法不正确的是
A. 合成气的主要成分为CO和H2
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. ①→②吸收能量
D. Ni在该反应中做催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
根据题意回答下列问题:
①写出酸H2A的电离方程式___。
②若溶液M由2mol/LNaHA溶液与2mol/LNaOH溶液等体积混合而得,则溶液M的pH___7(填“>”“<”或“=”);溶液M中各微粒的浓度关系正确的是___。
A.c(Na+)>c(A2-)>c(H+)>c(OH-)
B.c(HA-)+c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol/L
D.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个热化学方程式:
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ/mol
O2(g)=H2O(l) ΔH=-285.8kJ/mol
C3H8(g)+5O2(g)=4H2O(l)+3CO2(g) ΔH=-2220.0kJ/mol
已知:H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g) + Y(g) 2Z(g)的能量变化如图所示。下列说法正确的是( )
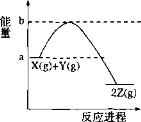
A.1 mol X(g)的能量一定高于1 mol Z(g)的能量
B.该反应一定不需要加热就可以进行
C.升高温度,该反应的正、逆反应速率都加快
D.其他条件不变,若加入催化剂,则反应物的平衡转化率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究NO和Cl2O(Cl2O是酸性氧化物,易溶于水)的性质,将两种气体同时通入水中,实验装置如图:
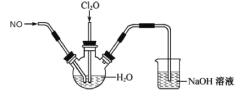
请回答:
(1)三颈瓶中检测到有2种强酸生成,用一个化学方程式表示_____。
(2)该实验装置有一处不合理,请指出_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大。X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出元素符号:Y__Z____W____。
(2)在一定条件下,由X单质与Z单质反应生成E,E在催化剂存在的条件下,可用于还原汽车尾气中的____,以减少对大气的污染。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为____。
(4)工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式____。该反应中被氧化的E与参与反应的E的质量之比___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com