
【题目】已知反应X(g) + Y(g) 2Z(g)的能量变化如图所示。下列说法正确的是( )
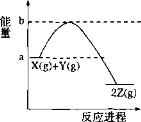
A.1 mol X(g)的能量一定高于1 mol Z(g)的能量
B.该反应一定不需要加热就可以进行
C.升高温度,该反应的正、逆反应速率都加快
D.其他条件不变,若加入催化剂,则反应物的平衡转化率提高
科目:高中化学 来源: 题型:
【题目】某研究小组为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,设计并实施了以下实验。
(1)实验1:使用下图装置通过干燥管的增重测量CO2的质量。
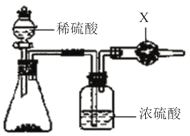
①盛放稀硫酸的仪器名称为________。
②试剂X为________。
③某同学认为装置中干燥管的增重并不能准确表示混合物与稀硫酸反应产生的CO2的质量,其理由是________。
(2)实验2:取a g混合物样品加热、冷却、称重,重复以上操作至固体质量不再变化,测得固体质量变为b g。
①写出加热过程中发生反应的化学方程式________。
②混合物中Na2CO3质量分数为(用a、b表示)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3
Na2CO3
B.Al(s)![]() Al2O3(s)
Al2O3(s)![]() Al(OH)3
Al(OH)3
C.AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D.MgCO3(s)![]() MgCl2(aq)
MgCl2(aq)![]() Mg(s)
Mg(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究温度对化学反应H2(g)+I2(g)![]() 2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
时间 | 0 | 20 | 40 | 60 | 80 | 100 | |
HI(g)的物质 的量分数 | T1 | 0 | 0.50 | 0.68 | 0.76 | 0.80 | 0.80 |
T2 | 0 | 0.60 | 0.72 | 0.75 | 0.75 | 0.75 | |
下列说法正确的是( )
A.T1温度下,0~20min之间,H2的平均反应速率为0.025mol·L-1·min-1
B.在T1温度下,该反应有可能在70min时已达到平衡状态
C.T2温度下,20min时的正反应速率大于40min时的逆反应速率
D.由表中数据可知,温度越高,H2(g)与I2(g)的反应限度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
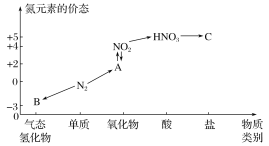
(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C常用于检验Cl-的在,则C的化学式为___。
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,甲是原电池装置,电池总反应为Mg+C1O-+H2O=C1-+Mg(OH)2,乙是电解池装置用于含Cr2O72-的工业废水的处理。下列说法错误的是

A.甲中负极发生的电极反应为Mg一2e-=Mg2+
B.乙中惰性电极作阴极
C.乙中Cr2O72-向惰性电极移动
D.当消耗3.6g镁时,理论上也消耗8.4g铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制药有限公司生产有多种型号的钙尔奇D片剂,为测定某型号片剂中碳酸钙含量,进行如下实验:取10片该片剂碾碎后放入足量的盐酸中充分反应(假设盐酸只与碳酸钙反应)后过滤,取滤液加(NH4)2C2O4使Ca2+生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中并稀释成1L溶液,取20.00mL,然后用0.0500mol·L-1KMnO4溶液滴定,反应中用去12.00mLKMnO4溶液,发生反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
请回答:
(1)该型号片剂中每片含碳酸钙的质量为_____克
(2)该公司一种“钙尔奇D600片剂”(其主要成分与题中某型号的片剂相同,仅仅是碳酸钙的含量不同)的部分文字说明如下:“本品每片含主要成分碳酸钙1.5g(相当于钙元素600mg),成人每天服用1片”。则某型号的片剂应称为“钙尔奇D_____(填数字)片剂。”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是( )
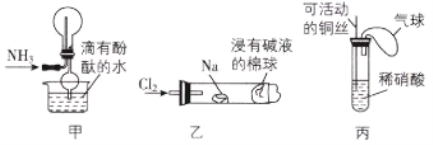
①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠反应的实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A.②③④B.①②③C.①②④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)2K2S + K2SO3 + 3H2SO4= 3K2SO4 + 3S↓+ 3H2O _______氧化剂_______
(2)2KMnO4 +5H2O2 + 3H2SO4 = K2SO4+2MnSO4+5O2↑ + 8H2O _______ 氧化剂_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com