

| 滴加的溶液 | 氨水 | 氯水 |
| 沉淀的化学式 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| A、1:2 | B、2:1 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:X>Z>Y>X>M |
| B、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C、由X、Y、Z、M四种元素形成的化合物不能含有有离子键 |
| D、由X元素形成的某种单质能导电,可以做电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:1:2 |
| C、1:2:1 |
| D、4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
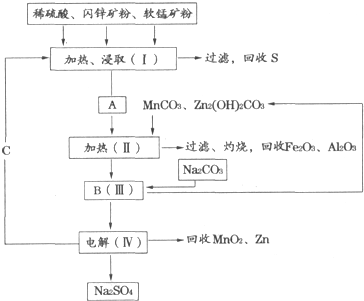
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| 分离酒精和水 | 分离水和 汽油 | 称取一定质量的NaOH | 分离氯化钠和 硝酸钾 |
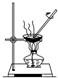 |  | 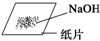 (天平及托盘略) | 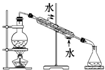 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com