
| A、配制一定物质的量浓度的溶液和萃取实验前,都必须检验所用仪器是否漏水 |
| B、将4 g NaOH溶入准确量取的100 mL水中,可制得浓度为1 mol/L的NaOH溶液 |
| C、如果不慎将稀盐酸沾到皮肤上,应先用NaOH溶液涂抹,再用水冲洗 |
| D、最好用蒸馏的方法分离出CCl4和水的混合物 |


科目:高中化学 来源: 题型:
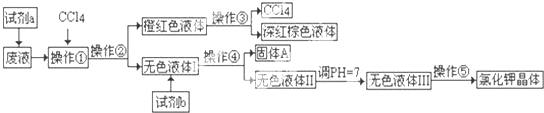
查看答案和解析>>
科目:高中化学 来源: 题型:
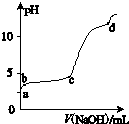 室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )| A、d点时,c(Na+):c (SO42-)=8:3 |
| B、b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| C、a~b段,溶液无沉淀生成,Al3+浓度不变 |
| D、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3 H2O?Al(OH)3+3 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
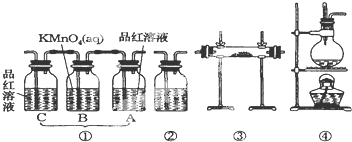
查看答案和解析>>
科目:高中化学 来源: 题型:
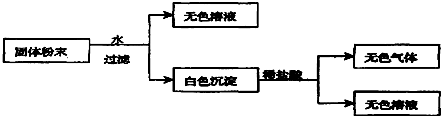
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com