
 工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.
工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.分析 (1)100LCr2O72-含量为108mg•L-1的含铬废水中含Cr2O72-物质的质量=100L×108mg•L-1的=108mg=0.108g,物质的量n(Cr2O72-)=$\frac{0.108g}{216g/mol}$=0.0005mol,结合二氧化硫和Cr2O72-反应的定量关系计算,Cr2O72-~2Cr3+~6e-,SO2~SO42-~2e-,Cr2O72-~3SO2~6e-;
(2)依据溶度积常数计算Ksp[Cr(OH)3]=1×10-30.室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-4mol•L-1),Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=1×10-30,c(OH-)=$\root{3}{\frac{1×1{0}^{-30}}{1×1{0}^{-4}}}$=10-8.67mol/L;
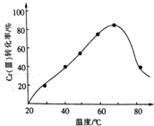
(3)三价铬Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4),发生的是氧化还原反应,反应达到平衡状态达到最大转化率,温度升高过氧化氢分解平衡逆向进行;
(4)n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)2×[0.04000mol+n(Fe3+)],加入氨水后市场的干燥固体粉末中,
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,据此书写化学式.
解答 解:(1)100LCr2O72-含量为108mg•L-1的含铬废水中含Cr2O72-物质的质量=100L×108mg•L-1的=10800mg=10.8g,物质的量n(Cr2O72-)=$\frac{0.108g}{216g/mol}$=0.05mol,结合二氧化硫和Cr2O72-反应的定量关系计算,Cr2O72-~2Cr3+~6e-,SO2~SO42-~2e-,
Cr2O72-~3SO2~6e-;
1 3
0.05mol n
n=0.15mol,
标准状况下体积=22.4L/mol×0.15mol=3.36L,
故答案为:3.36;
(2)Ksp[Cr(OH)3]=1×10-30.室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-4mol•L-1),Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=1×10-30,c(OH-)=$\root{3}{\frac{1×1{0}^{-30}}{1×1{0}^{-4}}}$=10-8.67mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-8.67}}$=10-5.33mol/L,PH=5.33,Cr3+使其浓度小于1×10-4mol•L-1,需调节溶液pH>6,
故答案为:>6;
(3)三价铬Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4),发生的是氧化还原反应,图象分析可知反应达到平衡状态达到最大转化率,温度升高超过70℃时过氧化氢分解,使平衡逆向进行,Cr(Ⅲ)转化率下降,
故答案为:较高温度下双氧水分解;
(4)n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)2×[0.04000mol+n(Fe3+)],加入氨水后市场的干燥固体粉末中,
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,
该发盐的可能组成为n(Al3+):[n(Fe2+)+n(Fe3+)]:n(OH-):n(SO42-)=0.1:0.05:0.01:0.2=10:5:1:20,化学式为:Al10Fe5(OH)(SO4)20,
n(Al3+):[n(Fe2+)+n(Fe3+)]:n(CO32-):n(SO42-)=0.1:0.05:0.005:0.2=20:10:1:40,化学式为Al20Fe10(CO3)(SO4)40,
答:n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)2×[0.04000mol+n(Fe3+)],加入氨水后市场的干燥固体粉末中,
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,
该发盐的可能组成为n(Al3+):[n(Fe2+)+n(Fe3+)]:n(OH-):n(SO42-)=0.1:0.05:0.01:0.2=10:5:1:20,化学式为:Al10Fe5(OH)(SO4)20,
n(Al3+):[n(Fe2+)+n(Fe3+)]:n(CO32-):n(SO42-)=0.1:0.05:0.005:0.2=20:10:1:40,化学式为Al20Fe10(CO3)(SO4)40,
该久置发盐的可能化学组成为Al10Fe5(OH)(SO4)20或Al20Fe10(CO3)(SO4)40.
点评 本题考查了物质组成的实验探究、溶度积常数计算、化学式计算应用、氧化还原反应定量计算的分析判断,掌握基础是解题关键,题目难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 福尔马林滴入高锰酸钾溶液 | 紫色褪去 | 高锰酸钾被还原 |
| B | 氯化钠晶体导电实验 | 不导电 | 晶体不存在离子 |
| C | AgI悬浊液滴入Na2S溶液 | 固体变黑 | Ksp(Ag2S)>Ksp(AgI) |
| D | 测量H2CO3的电离常数 | Ka1>Ka2 | H2CO3一级电离产生的H+对二级的电离起抑制作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
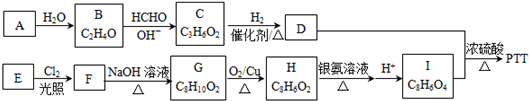
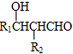
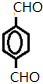 +4Ag(NH3)2OH$\stackrel{水浴}{→}$
+4Ag(NH3)2OH$\stackrel{水浴}{→}$ +4Ag↓+6NH3+2H2O.
+4Ag↓+6NH3+2H2O. .
.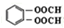 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
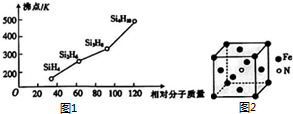 太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.
太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应①配平后,H2O的化学计量数为4 | |
| B. | 若反应②有2mol电子发生转移,则生成1molNO3- | |
| C. | 反应③中生成物X为CO32- | |
| D. | 1L废水完全脱氮所需CH3OH的质量为0.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 原文 | 水火既济而土和 | 以曾青凃铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 |
| 解释 | 黏土烧结成陶瓷 | 金属的置换 | 物质间转化的可逆性 | 重结晶方法提纯物质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
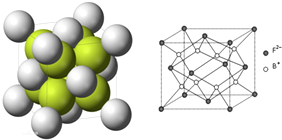
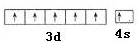 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com