
| A. | 反应物浓度 | B. | 反应温度 | ||
| C. | 反应物自身的性质 | D. | 是否使用催化剂 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
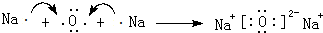 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量CH3COONa固体 | D. | 改用98%的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 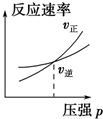 | B. | 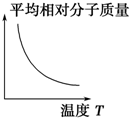 | C. | 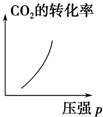 | D. | 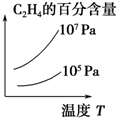 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
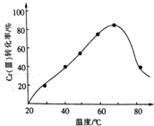 工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.
工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com