
| A. | 沸点:HF<HCl | B. | 熔点:Al>Na | C. | 密度:H2O>MgCl2 | D. | 硬度:C<Si |
分析 A.HF分子间含氢键,沸点高;
B.金属晶体中电荷越高,离子半径越小,熔点越大;
C.盐的密度比水的密度大;
D.原子晶体中,共价键越短,硬度越大.
解答 解:A.HF分子间含氢键,沸点高,则沸点为HF>HCl,故A错误;
B.金属晶体中电荷越高,离子半径越小,熔点越大,则熔点为Al>Na,故B正确;
C.盐的密度比水的密度大,则密度为H2O<MgCl2,故C错误;
D.原子晶体中,共价键越短,硬度越大,C-C键长小于Si-Si键长,则硬度为C>Si,故D错误;
故选B.
点评 本题考查不同晶体类型及性质,为高频考点,把握晶体类型、性质比较方法为解答的关键,侧重分析与应用能力的考查,注意选项A中氢键对性质的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用水鉴别乙醇、苯和溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①=② | B. | ①<② | C. | ①>② | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
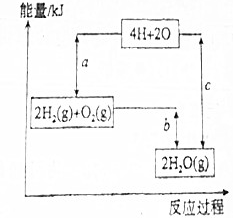
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 福尔马林滴入高锰酸钾溶液 | 紫色褪去 | 高锰酸钾被还原 |
| B | 氯化钠晶体导电实验 | 不导电 | 晶体不存在离子 |
| C | AgI悬浊液滴入Na2S溶液 | 固体变黑 | Ksp(Ag2S)>Ksp(AgI) |
| D | 测量H2CO3的电离常数 | Ka1>Ka2 | H2CO3一级电离产生的H+对二级的电离起抑制作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com