
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 福尔马林滴入高锰酸钾溶液 | 紫色褪去 | 高锰酸钾被还原 |
| B | 氯化钠晶体导电实验 | 不导电 | 晶体不存在离子 |
| C | AgI悬浊液滴入Na2S溶液 | 固体变黑 | Ksp(Ag2S)>Ksp(AgI) |
| D | 测量H2CO3的电离常数 | Ka1>Ka2 | H2CO3一级电离产生的H+对二级的电离起抑制作用 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.醛基能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
B.含有自由移动电子或离子的物质能导电;
C.溶度积常数大的物质能转化为溶度积常数小的物质;
D.碳酸第一步电离出的氢离子与第二步电离出的氢离子产生同离子效应.
解答 解:A.甲醛能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该反应中酸性高锰酸钾作氧化剂,被还原,故A正确;
B.含有自由移动电子或离子的物质能导电,氯化钠是由钠离子和氯离子构成的,但氯化钠晶体中不存在自由移动的离子,所以不导电,故B错误;
C.溶度积常数大的物质能转化为溶度积常数小的物质,AgI悬浊液滴入Na2S溶液,固体变黑,说明Ksp(Ag2S)<Ksp(AgI),故C错误;
D.碳酸第一步电离出的氢离子与第二步电离出的氢离子产生同离子效应,所以第二步抑制第一步电离,但电离平衡常数无法用肉眼看到,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的性质、物质的导电性、难溶物转化、弱电解质的电离等知识点,明确实验原理、物质的性质是解本题关键,侧重考查学生分析判断能力,注意电解质与导电性的关系,易错选项是D.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 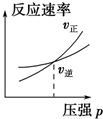 | B. | 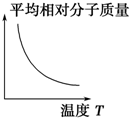 | C. | 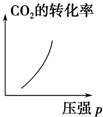 | D. | 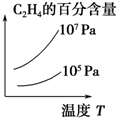 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离 子 | 要 求 |
| A | K+、AlO2-、Cl-、MnO4- | c(K+)<c(Cl-) |
| B | Fe3+、NO3-、I-、HCO3- | 逐滴加入盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH2COOH | 逐滴加入NaOH溶液立即有气体产生 |
| D | Na+、Cu2、Cl-、SO42- | 逐滴加氨水先有沉淀产生,后沉淀消失 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
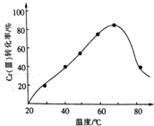 工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.
工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
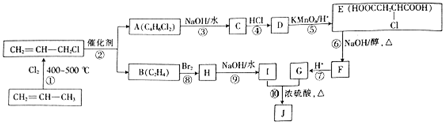
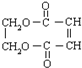 .
. +3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.
+3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入 | 实验Ⅰ | 1.5mL 1mol•L-1 CuSO4溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL 1mol•L-1 CuCl2溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
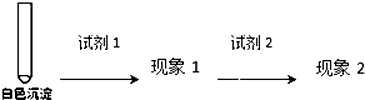
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com