
分析 (1)配制2.5mol/L 的稀硫酸溶液90mL,应选择100mL容量瓶,依据C=$\frac{1000ρω}{M}$计算质量分数为98%,密度为1.84g/cm3的浓硫酸的物质的量浓度,依据溶液稀释过程中溶质是物质的量保持不变计算需要浓硫酸的体积;
(2)根据配制溶液的实验操作过程选择所用仪器;
(3)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化;若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(4)根据n=cV计算出硫酸的物质的量,再计算出含有氢离子的物质的量,从而可知消耗氢氧化钠的物质的量,再根据V=$\frac{n}{C}$计算出消耗氢氧化钠溶液的体积;根据c=$\frac{n}{V}$计算出钠离子的浓度.
解答 解:(1)实验室无90ml容量瓶,须按100ml容量瓶计算,根据C浓×V浓=C稀×V稀,2.5mol/L×0.1L=$\frac{VmL×1.84g/c{m}^{3×}98%}{98g/mol}$,解得V=13.6mL,
故答案为:13.6;
(2)配制步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作,一般量筒量取浓硫酸,把浓硫酸倒入烧杯进行溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,配成100mL溶液,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、100mL容量瓶,所以还需要胶头滴管、100mL容量瓶,
故答案为:胶头滴管、100mL容量瓶;
(3)A.量取浓硫酸时,仰视读数,导致量取的浓硫酸体积偏大,溶质硫酸的物质的量偏大,溶液浓度偏高,故A选;
B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,溶质硫酸的物质的量偏大,溶液浓度偏高,故B选;
C.稀释硫酸时,有溶液溅到桌面上,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故C不选;
D.没有洗涤稀释硫酸的烧杯和玻璃棒,导致溶质部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故D不选;
E.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液体积偏大,溶液浓度偏低,故E不选;
F.容量瓶不干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故F不选;
故选:AB;
(4)40mL 2.5mol/L的稀硫酸中含有氢离子的物质的量为:2.5mol/L×2×0.04L=0.2mol,发生中和反应需要消耗0.2molNaOH,消耗5mol/L的氢氧化钠溶液的体积为:$\frac{0.2mol}{5mol/L}$=0.04L=40mL;
混合液体积为40mL+40mL=80mL=0.08L,混合液中含有钠离子的物质的量为0.2mol,则反应后钠离子浓度为:$\frac{0.2mol}{0.08L}$=2.5mo/L,
故答案为:40;2.5mol∕L.
点评 本题考查了一定物质的量浓度溶液的配制方法,题目难度中等,明确配制一定物质的量浓度的溶液方法为解答关键,注意掌握误差分析的方法与技巧,试题培养了学生的学生的化学实验能力.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:填空题
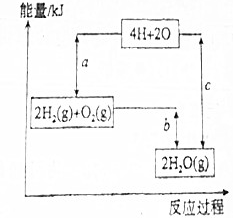
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
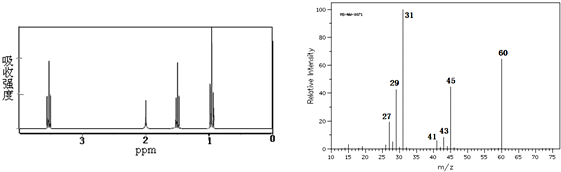
| A. | CH3CH2CH2OH | B. | CH3CH(OH)CH3 | C. | CH3CH2OCH3 | D. | CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再加点溶质到容量瓶中去 | B. | 影响不大,不再处理 | ||
| C. | 重新配制 | D. | 以上措施都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 福尔马林滴入高锰酸钾溶液 | 紫色褪去 | 高锰酸钾被还原 |
| B | 氯化钠晶体导电实验 | 不导电 | 晶体不存在离子 |
| C | AgI悬浊液滴入Na2S溶液 | 固体变黑 | Ksp(Ag2S)>Ksp(AgI) |
| D | 测量H2CO3的电离常数 | Ka1>Ka2 | H2CO3一级电离产生的H+对二级的电离起抑制作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
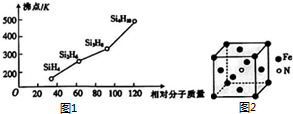 太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.
太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝屑有氢气放出的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 常温下pH=12的溶液中:K+、Na+、CO32-、AlO2- | |
| C. | 在葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ | |
| D. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-14的溶液中:Al3+、NH4+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com