
【题目】我国是世界产镁大国,金属镁的产量居世界前列。一种由白云石(主要成分为CaOMgO,含少量SiO2、A12O3、Fe2O3等杂质)冶炼金属镁的工艺流程如图:
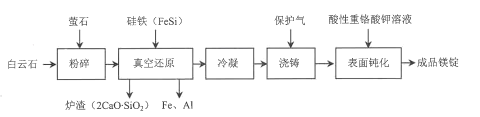
已知:萤石的主要成分是CaF2,用于降低真空还原反应的活化能。
回答下列问题:
(1)①粉碎的主要目的________。
②萤石在真空还原反应中的作用是________(填标号)。
A.氧化剂 B.还原剂 C.催化剂
(2)Mg2+、Ca2+、Fe3+、Fe2+、A13+五种离子的氧化性由强到弱的顺序为Fe3+>Fe2+>___(用离子符号表示)。
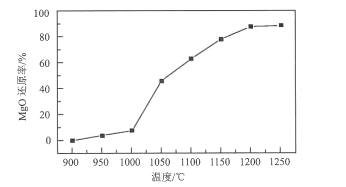
(3)结合流程以及如图温度对MgO还原率的影响关系,真空还原反应温度的最佳选择为___;高温真空还原时,CaO、MgO和FeSi反应生成单质镁的化学方程式为___。
(4)液态镁浇铸成镁锭时,通入的保护气不可选用N2或CO2,其原因是_______。
(5)镁锭冷却后,用酸性K2Cr2O7溶液进行表面钝化形成致密的氧化物保护膜,还原产物为Cr3+。该反应的离子方程式为________。
(6)为测定镁锭的纯度,称取a g除去氧化膜的成品镁锭样品溶于足量稀硫酸中,配成250 mL溶液。取25 mL该溶液,用0.1000 mol/L的EDTA标准溶液进行滴定(杂质不干扰滴定),三次滴定平均消耗EDTA标准溶液V mL(己知Mg2+与EDTA反应的化学计量数之比为1:1)。该样品的纯度为___%。
【答案】增大反应物表面积,加快反应速率 C Al3+>Mg2+>Ca2+ 1200℃ 2(CaO·MgO)+FeSi ![]() 2CaO·SiO2+Fe+2Mg↑ 镁在较高温度下会和N2或CO2发生反应 3Mg+8H++Cr2O72-=3MgO+2Cr3++4H2O
2CaO·SiO2+Fe+2Mg↑ 镁在较高温度下会和N2或CO2发生反应 3Mg+8H++Cr2O72-=3MgO+2Cr3++4H2O ![]()
【解析】
白云石主要成分为CaOMgO,还含有杂质SiO2、A12O3、Fe2O3等,经粉碎后与萤石、FeSi在高温下反应产生炉渣2CaO·SiO2及Fe、Mg、Al,其中萤石的作用是降低真空还原反应的活化能,将得到的镁蒸气经惰性气体冷凝后浇铸呈固态,为防止Mg锭氧化变质,常用酸性重铬酸钾溶液氧化,使Mg表面产生一层致密的氧化物保护膜,就得到成品镁锭。
(1)①粉碎白云石的主要目的增大反应物表面积,加快反应速率;
②萤石在真空还原反应中降低了反应的活化能,使更多的物质快速反应,因此其作用是作催化剂,故合理选项是C;
(2)元素的金属性越强,其相应的离子的氧化性就越弱。由于元素金属性Ca>Mg>Al>Fe,所以Mg2+、Ca2+、Fe3+、Fe2+、A13+五种离子的氧化性由强到弱的顺序为Fe3+>Fe2+> Al3+>Mg2+>Ca2+;
(3)根据图示可知在温度为900~1000℃时,MgO还原率较低,此后随着温度的升高,MgO还原率逐渐增大,当温度为1200℃时还原率接近90%,此后温度升高,还原率变化不大,故真空还原反应选择的最佳温度为1200℃;根据图示可知:高温真空还原时,CaO、MgO和FeSi反应生成单质Mg、2CaO·SiO2、Fe,该反应的化学方程式为2(CaO·MgO)+FeSi ![]() 2CaO·SiO2+Fe+2Mg↑;
2CaO·SiO2+Fe+2Mg↑;
(4)Mg在较高温度下能够与N2反应产生Mg3N2,能够与CO2反应产生MgO和C单质,所以液态镁浇铸成镁锭时,通入的保护气不可选用N2或CO2;
(5)在酸性条件下,Mg能够被K2Cr2O7氧化为MgO,同时K2Cr2O7被还原产生Cr2(SO4)3,反应的离子方程式为:3Mg+8H++Cr2O72-=3MgO+2Cr3++4H2O;
(6)Mg与H2SO4反应产生MgSO4和H2,MgSO4与EDTA标准溶液反应,由于Mg2+与EDTA反应的物质的量的比是1:1,故关系式为Mg~Mg2+~EDTA,a g除去氧化膜的镁锭溶于硫酸后形成250 mL溶液,25 mL溶液反应消耗0.1000 mol/LEDTA标准溶液V mL,其物质的量为n(EDTA)=0.1000 mol/L×V×10-3 L= V×10-4 mol,则250 mL溶液消耗EDTA标准溶液的物质的量为n(EDTA)总=![]() ×V×10-4 mol=V×10-3 mol,则n(Mg)= n(EDTA)总=V×10-3 mol,m(Mg)=n·M= V×10-3 mol×24 g/mol=2.4V×10-2 g,所以该样品的纯度为
×V×10-4 mol=V×10-3 mol,则n(Mg)= n(EDTA)总=V×10-3 mol,m(Mg)=n·M= V×10-3 mol×24 g/mol=2.4V×10-2 g,所以该样品的纯度为![]() ×100%=
×100%=![]() %。
%。


科目:高中化学 来源: 题型:
【题目】已知O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大。回答下列问题:
(1)Lv在周期表中的位置是_________。
(2)下列有关性质的比较,能用元素周期律解释的是_________。
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因_________。
(4)实验室用如下方法制备H2S并进行性质验证。
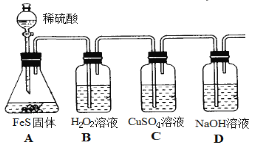
①设计B装置的目的是证明_________,B中实验现象为_______________。
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是_______________。
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
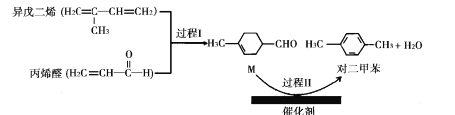
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种D.M能发生取代,加成,加聚和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于功能高分子材料的说法不正确的是( )
A.生物高分子材料、隐身材料、液晶高分子材料等属于功能高分子材料
B.高分子分离膜可用于海水淡化、分离工业废水、浓缩天然果汁等
C.用于制造![]() 芯片的良好半导体材料单晶硅属于功能高分子材料
芯片的良好半导体材料单晶硅属于功能高分子材料
D.在淀粉、纤维的高分子链上再接上含强亲水性原子团的支链,可提高它们的吸水能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.芳香烃的组成通式是![]() (
(![]() 为正整数)
为正整数)
B.分子中仅含有一个苯环的烃类物质都是苯的同系物
C.苯和甲苯都不能使酸性![]() 溶液褪色
溶液褪色
D.苯和甲苯都能与![]() 、硝酸等发生取代反应
、硝酸等发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
②苯环上的取代基对新导入的取代基进入苯环的位置有显著的影响。如图表示以苯为原料制备一系列有机物的转化过程:
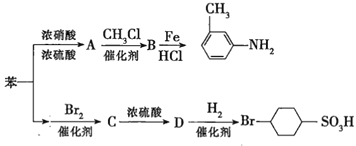
(1)![]() 是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为
是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为![]() 的化学方程式是______。
的化学方程式是______。
(2)在“苯![]() ”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
(3)有机物![]() 苯环上的二氯代物有__________种结构;
苯环上的二氯代物有__________种结构;![]() 的所有原子____(填“在”或“不在”)同一平面上。
的所有原子____(填“在”或“不在”)同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨酸钾(CH3CH=CHCH=CHCOOK,简写为RCOOK)是常用的食品防腐剂,其水溶液显碱性。下列叙述正确的是( )
A.山梨酸和山梨酸钾都是强电解质
B.稀释山梨酸钾溶液时,n(OH-)、c(OH-)都减小
C.若山梨酸的电离常数为Ka,则RCOOK稀溶液中c(K+)=c(RCOO-)[1+ ]
]
D.山梨酸能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:
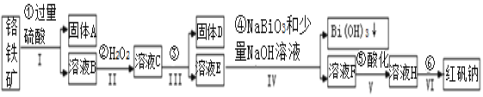
查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是__________________。
(2)步骤③加的试剂为_____________,此时溶液pH要调到5的目的_______________ 。
(3)写出反应④的离子反应方程式______________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式_________________。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是__________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别以下列各组物质作为单体在一定条件下,通过缩聚反应能合成高分子化合物的是( )
①乙烯、丙烯、苯乙烯
②乙酸、乙二醇
③1,![]() 己二酸、1,
己二酸、1,![]() 己二胺
己二胺
④对苯二甲酸、乙二醇
⑤α-氨基乙酸、α-氨基丙酸
⑥α-羟基丙酸
A.①③⑤⑥B.①②③④C.③④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com