
【题目】实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用(选填编号),其理由是 . a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
(2).漂白性用如图所示装置(气密性良好)进行实 验,观察到如下现象:ⅰ中红色褪去、ⅱ中无变化.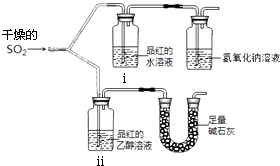
①足量碱石灰的作用是 .
②从实验中可知使品红的水溶液褪色的 微粒可能是 .
(3)实验小组进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO ![]() 或SO
或SO ![]() .你认为这一结论是否正确 , 理由是 .
.你认为这一结论是否正确 , 理由是 .
(4).还原性将SO2通入FeCl3溶液中,使其充分反应.
①SO2与FeCl3反应的离子方程式是 , 如何检验该反应所得含氧酸根离子 .
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色.
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32﹣ .
则②中红棕色变为浅绿色的原因是 .
【答案】
(1)b;98%浓硫酸中c(H+)小不易反应,10%硫酸溶液水含量高不易使SO2放出
(2)防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染;H2SO3、HSO ![]() 、SO
、SO ![]()
(3)不正确;因为SO ![]() 离子和HSO3﹣离子都会水解生成H2SO3
离子和HSO3﹣离子都会水解生成H2SO3
(4)2Fe3++SO2+2H2O=2Fe2++SO ![]() +4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO
+4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO ![]() ;混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO
;混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO ![]() (aq),Fe3+会与SO
(aq),Fe3+会与SO ![]() 发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液
发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液
【解析】解:(1).硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,98%浓硫酸中硫酸是以分子形式存在,c(H+)小不易反应,10%硫酸溶液水含量高,二氧化硫易溶于水,不易使SO2放出,所以选取70%硫酸,故答案为:b;98%浓硫酸中c(H+)小不易反应,10%硫酸溶液水含量高不易使SO2放出(2)①实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要吸收处理,故碱石灰的作用是防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染,
故答案为:防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染;
②SO2不能使口红褪色,而其水溶液可以,因此使品红褪色的微粒可能是H2SO3、HSO ![]() 、SO
、SO ![]() ,
,
故答案为:H2SO3、HSO ![]() 、SO
、SO ![]() ;(3)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO
;(3)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO ![]() 、SO
、SO ![]() 、H2SO3 , 所以不能确定使品红褪色的微粒肯定是HSO
、H2SO3 , 所以不能确定使品红褪色的微粒肯定是HSO ![]() 或SO
或SO ![]() ,
,
故答案为:不正确,因为SO ![]() 离子和HSO
离子和HSO ![]() 离子都会水解生成H2SO3;(4)①SO2与FeCl3反应的离子方程式是:2Fe3++SO2+2H2O=2Fe2++SO
离子都会水解生成H2SO3;(4)①SO2与FeCl3反应的离子方程式是:2Fe3++SO2+2H2O=2Fe2++SO ![]() +4H+ , 检验SO42﹣的方法是:取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42﹣ ,
+4H+ , 检验SO42﹣的方法是:取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42﹣ ,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO ![]() ;
;
②混合液中存在平衡FeSO3(s)Fe2+(aq)+SO (aq),Fe3+会与SO32﹣发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液,
故答案为:混合液中存在平衡FeSO3(s)Fe2+(aq)+SO ![]() (aq),Fe3+会与SO32﹣发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液.
(aq),Fe3+会与SO32﹣发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液.
(1)硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,如果硫酸浓度过大,硫酸是以分子形式存在,电离出H+很少,不能反应生成SO2 , 如果硫酸浓度过低,二氧化硫易溶于水,不利于二氧化硫放出;(2)①实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要尾气处理;
②SO2不能使品红的乙醇溶液褪色,而其水溶液可以,使品红褪色的微粒含有S元素;(3)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO ![]() 、SO
、SO ![]() 、H2SO3;(4)①铁离子具有强氧化性,在溶液中可以将二氧化硫氧化为硫酸根;利用盐酸酸化的氯化钡溶液检验硫酸根离子;
、H2SO3;(4)①铁离子具有强氧化性,在溶液中可以将二氧化硫氧化为硫酸根;利用盐酸酸化的氯化钡溶液检验硫酸根离子;
②混合液中存在平衡FeSO3(s)Fe2+(aq)+SO ![]() (aq),Fe3+会与SO
(aq),Fe3+会与SO ![]() 发生氧化还原反应,使平衡右移,最终生成FeSO4溶液.
发生氧化还原反应,使平衡右移,最终生成FeSO4溶液.


科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示.下列有关说法错误的是( ) 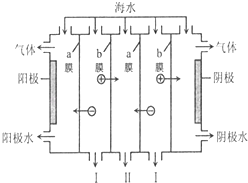
A.阳极可发生电极反应:2Cl﹣﹣2e﹣═Cl2↑
B.阴极附近溶液的pH减小
C.a膜为阴离子交换膜,b膜为阳离子交换膜
D.I,II分别是淡水、浓海水出口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种无色溶液,它们分别是葡萄糖溶液、蔗糖溶液、淀粉溶液、甲酸乙酯中的一种。经实验可知:
(1)B、C均能发生银镜反应。
(2)A遇碘水变蓝色。
(3)A、C、D均能发生水解反应,水解液均能发生银镜反应。试判断它们各是什么物质,并写出有关化学反应方程式:
①A是__________,B是__________,C是____________,D是________。
②有关化学反应方程式:
a.蔗糖水解:__________________________,
b.葡萄糖发生银镜反应:____________________,
c.甲酸乙酯水解:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色固体粉末,由Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的三种物质组成,取样进行如下实验:
I.取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
II.向I中滤出的沉淀中加入足量稀盐酸,沉淀全溶解,并生产无色气体。
(1)则原混合物中一定不存在 ,一定存在 。
(2)实验中发生反应的化学方程式: 。
(3)设计实验进一步确定混合物的组成,简述实验步骤、现象和结论。 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅰ是制备液晶材料的中间体之一,分子式为:(C11H12O3),其分子中含有醛基和酯基.Ⅰ可以用E和H在一定条件下合成:
已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R﹣CH=CH2 ![]() R﹣CH2CH2OH
R﹣CH2CH2OH
③化合物F苯环上的一氯代物只有两种;且F遇到氯化铁溶液会显示紫色
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,
例如:CH3CH(OH)2CH3不稳定,失去水形成羰基,产物为  ,
,
回答下列问题:
(1)A的化学名称为
(2)由C转化为D的化学方程式为 .
(3)E的分子式为 , 所含官能团名称为 .
(4)F生成G的化学方程式为 , 该反应类型为 .
(5)I的结构简式为 .
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件结构共种(不考虑立体异构)①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2 .
J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的书写正确的是( )
A.基态Mg原子的核外电子排布图: ![]()
B.过氧化氢的电子式: ![]()
C.As原子的简化电子排布式:[Ar]4s24p3
D.羟基的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式正确的是( )
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH﹣═Al(OH)3↓
B.90℃时,测得纯水中c(H+)?c(OH﹣)═3.8×10﹣13:H2O(l)?H+(aq)+OH﹣(aq)△H<0
C.FeCl3溶液中通入SO2 , 溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO ![]() +4H+
+4H+
D.碳酸钠溶液滴入酚酞变红:CO ![]() +2H2O?H2CO3+2OH﹣
+2H2O?H2CO3+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮肥的说法正确的是( )
A.硫铵与石灰混用肥效增强
B.所有铵态氮肥中,氮元素化合价都是 3 价
C.使用碳铵应深施盖土
D.尿素属于氨态氮肥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com