
【题目】下列解释实验事实的方程式正确的是( )
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH﹣═Al(OH)3↓
B.90℃时,测得纯水中c(H+)?c(OH﹣)═3.8×10﹣13:H2O(l)?H+(aq)+OH﹣(aq)△H<0
C.FeCl3溶液中通入SO2 , 溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO ![]() +4H+
+4H+
D.碳酸钠溶液滴入酚酞变红:CO ![]() +2H2O?H2CO3+2OH﹣
+2H2O?H2CO3+2OH﹣
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.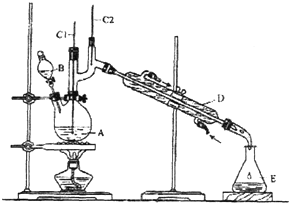
发生的反应如下:
CH3CH2CH2CH2OH ![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90﹣95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75﹣77℃馏分,产量2.0g.回答下列问题:
(1)上述装置图中,B仪器的名称是 , D仪器的名称是;
(2)加入沸石的作用是;
(3)分液漏斗使用前必须进行的操作是 (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在层(填“上”或“下”)
(5)反应温度应保持在90﹣95℃.其原因是
(6)本实验中,正丁醛的产率为 %.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用(选填编号),其理由是 . a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
(2).漂白性用如图所示装置(气密性良好)进行实 验,观察到如下现象:ⅰ中红色褪去、ⅱ中无变化.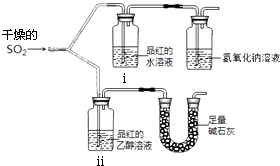
①足量碱石灰的作用是 .
②从实验中可知使品红的水溶液褪色的 微粒可能是 .
(3)实验小组进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO ![]() 或SO
或SO ![]() .你认为这一结论是否正确 , 理由是 .
.你认为这一结论是否正确 , 理由是 .
(4).还原性将SO2通入FeCl3溶液中,使其充分反应.
①SO2与FeCl3反应的离子方程式是 , 如何检验该反应所得含氧酸根离子 .
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色.
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32﹣ .
则②中红棕色变为浅绿色的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学知识可以帮助解决日常生活中遇到的许多问题,下列说法错误的是
A.胃酸过多的病人,可以服用碳酸氢钠来中和胃酸
B.明矾有吸附性,可用于自来水的杀菌消毒
C.溴化银见光易分解,是一种重要的感光材料,是胶卷中必不可少的成分
D.Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法及相关内容填写下列有机物的名称、结构简式及分子式等空白。
(1)  名称:____________。
名称:____________。
(2)写出分子式为C4H8的所有烯烃的结构简式及名称:_____________________。
(3)(CH3)3CC(CH3)2CH(CH3)2名称:______________________。
(4) 名称:___________。分子式:________。
名称:___________。分子式:________。
(5)  名称:________________。
名称:________________。
(6) 的名称是________。
的名称是________。
(7) 名称:_______________________。
名称:_______________________。
(8)3-苯基-1-丙醇的结构简式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+
B.粗硅 ![]() SiCl4
SiCl4 ![]() Si均能一步实现
Si均能一步实现
C.33gCH≡C﹣CH=CH﹣CH3中所含的π键数、12g石墨中所含的碳碳键数均为1.5mol
D.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+ , 可能含有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下问题:
(1)C、N、O三种元素的第一电离能由大到小的顺序是 .
(2)C、Si、N的电负性由大到小的顺序是 .
(3)氟化氢水溶液中存在的氢键有种.
(4)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,Ni的基态原子有种能量不同的电子.很多不饱和有机物在Ni催化下可以H2发生加成反应.如①CH2=CH2、②HC≡CH、③ ![]() 、④HCHO,其中碳原子采取sp2杂化的分子有(填物质编号),HCHO分子的立体构型为
、④HCHO,其中碳原子采取sp2杂化的分子有(填物质编号),HCHO分子的立体构型为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中“烧酒”条目写道:“自元时始创其法,用浓酒和糟人甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”文中所用之“法”是指 ( )
A.蒸馏B.渗析C.萃取D.过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题: 
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于(填“晶 体”或“非晶体”).
(2)基态铜原子有个未成对电子,二价铜离子的电子排布式为 , 在CuSO4溶液 中滴入过量氨水,形成配合物的颜色为 .
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2 , 1mol(SCN)2分子中含有.键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是 .
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2﹣的配位数为 .
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为(用含“a、NA 的代数式表示)gcm﹣3 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com