
【题目】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题: 
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于(填“晶 体”或“非晶体”).
(2)基态铜原子有个未成对电子,二价铜离子的电子排布式为 , 在CuSO4溶液 中滴入过量氨水,形成配合物的颜色为 .
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2 , 1mol(SCN)2分子中含有.键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是 .
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2﹣的配位数为 .
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为(用含“a、NA 的代数式表示)gcm﹣3 .
【答案】
(1)晶体
(2)1;1s22s22p63s23p63d9;深蓝色
(3)5NA;异硫氰酸分子间可形成氢键,而硫氰酸不能
(4)4
(5)![]()
【解析】解:(1)晶体中粒子在三维空间里呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,故答案为:晶体;(2)Cu为29号元素,电子排布式为1s22s22p63s23p63d104s1 , 可以看出只有4S轨道上的电子未成对,二价铜离子的电子排布式为1s22s22p63s23p63d9 , 在CuS04溶液 中滴入过量氨水,形成配合物为[Cu(NH3)4]2+ , 为深蓝色,故答案为:1;1s22s22p63s23p63d9;深蓝色;(3)(SCN)2分子结构式为N≡C﹣S﹣S﹣C≡N,1个N≡C键中有1个θ键,其余两个为π键,1mol(SCN)2分子中含有θ键的数目为5NA , 异硫氰酸(H﹣N=C=S)分子中N原子上连接有H原子,分子间能形成氢键,故沸点高,故答案为:5NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;(4)根据图1,距离S2﹣最近的锌离子有4个,即S2﹣的配位数为4,故答案为:4;(5)Cu原子位于晶胞面心,数目为6× ![]() =3,Au原子为晶胞顶点,数目为8×
=3,Au原子为晶胞顶点,数目为8× ![]() =1,晶胞体积V=(a×10﹣7)3 , 密度
=1,晶胞体积V=(a×10﹣7)3 , 密度 ![]() =
= 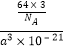 =
= ![]() gcm﹣3 , 故答案为:
gcm﹣3 , 故答案为: ![]() . (1)根据晶体和非晶体中微粒的排列特点分析;(2)Cu为29号元素,电子排布式为1s22s22p63s23p63d104s1;配合离子[Cu(NH3)4]2+为深蓝色;(3)(SCN)2分子结构式为N≡C﹣S﹣S﹣C≡N,1个N≡C键中有1个θ键,其余两个为π键;分子间有氢键的能使物质熔沸点升高;(4)根据晶胞的结构图可求S2﹣的配位数;(5)根据均摊法计算出晶胞中Cu、Au原子数,根据
. (1)根据晶体和非晶体中微粒的排列特点分析;(2)Cu为29号元素,电子排布式为1s22s22p63s23p63d104s1;配合离子[Cu(NH3)4]2+为深蓝色;(3)(SCN)2分子结构式为N≡C﹣S﹣S﹣C≡N,1个N≡C键中有1个θ键,其余两个为π键;分子间有氢键的能使物质熔沸点升高;(4)根据晶胞的结构图可求S2﹣的配位数;(5)根据均摊法计算出晶胞中Cu、Au原子数,根据 ![]() 计算密度.
计算密度.


科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式正确的是( )
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH﹣═Al(OH)3↓
B.90℃时,测得纯水中c(H+)?c(OH﹣)═3.8×10﹣13:H2O(l)?H+(aq)+OH﹣(aq)△H<0
C.FeCl3溶液中通入SO2 , 溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO ![]() +4H+
+4H+
D.碳酸钠溶液滴入酚酞变红:CO ![]() +2H2O?H2CO3+2OH﹣
+2H2O?H2CO3+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮肥的说法正确的是( )
A.硫铵与石灰混用肥效增强
B.所有铵态氮肥中,氮元素化合价都是 3 价
C.使用碳铵应深施盖土
D.尿素属于氨态氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL 0.50molL﹣1的盐酸与50mL 0.55molL﹣1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( ) 
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若烧杯上不盖硬纸板,测得的△H将偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ ![]() (对苯醌)═N2H4+
(对苯醌)═N2H4+ ![]() (对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 .
(对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 .
(2)25℃时,将nmolL﹣1的氨水与0.1molL﹣1的盐酸等体积混合. ①若混合溶液中c(NH ![]() )=c(Cl﹣),则溶液的pH= .
)=c(Cl﹣),则溶液的pH= .
②若混合溶液中c(NH ![]() )>c(Cl﹣),则反应的情况可能为 .
)>c(Cl﹣),则反应的情况可能为 .
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)2NH3(g)△H=bkJmol﹣1 , 其化学平衡常数K与温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
①写出该反应的化学平衡常数的表达式: , b(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=﹣1266.8kJmol﹣1②N2(g)+O2(g)═2NO(g)△H=+180.5kJmol﹣1
写出氨高温催化氧化的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3 ![]() +8HNO3
+8HNO3 ![]() 3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.
3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示. 
实验步骤:
Ⅰ在60mL三颈烧瓶中加入16.0mL50%硝酸(ρ=1.31gcm﹣3)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b.用仪器b滴加5.3mL环己醇(ρ=0.9624gcm﹣3),搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液.
Ⅱ首先将瓶内液体加热到50℃左右,开动搅拌器,滴入环己醇,使反应处于微沸状态.滴加完毕后于90℃左右水浴加热20分钟,至反应完毕.
Ⅲ趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重.
Ⅳ将粗产品在水中进行重结晶操作.
请回答下列问题:
(1)仪器a的名称是 . 仪器b在使用前应 .
(2)偏钒酸铵的作用是 .
(3)反应完成后,趁热倒出反应液的目的是 .
(4)本实验中己二酸的理论产量为 .
(5)用纯碱液吸收尾气时发生的相关化学反应为: 2NO2+NaCO3═NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3═2NaNO2+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g.则吸收液中NaNO2和NaNO3的物质的量之比为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反应,生成另一种气体A.气体A完全燃烧时,需要3.5倍体积的氧气,则金属钠与碳化钙的物质的量之比是( )
A.2:1
B.1:2
C.4:1
D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:

据此,下列判断中正确的是( )
A.该溶液中存在着SO2分子
B.该溶液中H+浓度是SO32-浓度的2倍
C.向该溶液中加入足量的酸都能放出SO2气体
D.向该溶液中加入过量NaOH可得到Na2SO3、NaHSO3和NaOH的混合溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com