
【题目】运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ ![]() (对苯醌)═N2H4+
(对苯醌)═N2H4+ ![]() (对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 .
(对苯酚),N2H4的结构式为 , 该电池正极的电极反应式为 .
(2)25℃时,将nmolL﹣1的氨水与0.1molL﹣1的盐酸等体积混合. ①若混合溶液中c(NH ![]() )=c(Cl﹣),则溶液的pH= .
)=c(Cl﹣),则溶液的pH= .
②若混合溶液中c(NH ![]() )>c(Cl﹣),则反应的情况可能为 .
)>c(Cl﹣),则反应的情况可能为 .
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)2NH3(g)△H=bkJmol﹣1 , 其化学平衡常数K与温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
①写出该反应的化学平衡常数的表达式: , b(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=﹣1266.8kJmol﹣1②N2(g)+O2(g)═2NO(g)△H=+180.5kJmol﹣1
写出氨高温催化氧化的热化学方程式: .
【答案】
(1)![]() ;
;
(2)7;a
(3)![]() ;小于;小于
;小于;小于
(4)4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=﹣905.8KJ/mol
【解析】解:(1)肼中相当于氨气分子中一个氢原子被氨基取代,所以肼的结构式为 ![]() ; 该电池正极上
; 该电池正极上 ![]() 得到电子生成
得到电子生成 ![]() ,电极反应式为:
,电极反应式为:  ,
,
故答案为: ![]() ;
;  ;(2)①根据电荷守恒得:c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),溶液中c(Cl﹣)=c(NH
;(2)①根据电荷守恒得:c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),溶液中c(Cl﹣)=c(NH ![]() ),所以c(OH﹣)=c(H+),所以溶液呈中性,即pH=7,
),所以c(OH﹣)=c(H+),所以溶液呈中性,即pH=7,
故答案为:7;②根据电荷守恒得:c(NH ![]() )+c(H+)=c(OH﹣)+c(Cl﹣),当c(NH
)+c(H+)=c(OH﹣)+c(Cl﹣),当c(NH ![]() )>c(Cl﹣)时,则c(H+)<c(OH﹣),溶液呈碱性;
)>c(Cl﹣)时,则c(H+)<c(OH﹣),溶液呈碱性;
a.盐酸不足,氨水剩余,溶液显碱性,与题意相符,故a可选;
b.氨水与盐酸恰好反应,生成氯化铵,铵根离子水解显酸性,与题意不符,故b不选;
c.盐酸过量,溶液呈酸性,与题意不符,故c不选;
故答案为:a;(3)①N2(g)+3H2(g)2NH3(g)△H=bkJmol﹣1 , 平衡常数K= ![]() ,
,
由表中数据可知:平衡常数随温度升高而减小,说明升高温度,平衡逆向进行,逆向是吸热反应,故正反应为放热反应,故b小于0,
故答案为: ![]() ;小于;②400°C N2(g)+3H2(g)2NH3(g)的K=0.5,400℃时,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,浓度分别为
;小于;②400°C N2(g)+3H2(g)2NH3(g)的K=0.5,400℃时,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,浓度分别为 ![]() =6mol/L,
=6mol/L, ![]() =4mol/L,
=4mol/L, ![]() =2mol/L,Qc=
=2mol/L,Qc= ![]() =1.1>K,说明平衡逆向进行,v正(N2)<v逆(N2);
=1.1>K,说明平衡逆向进行,v正(N2)<v逆(N2);
故答案为:小于;(4)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=﹣1266.8kJmol﹣1②N2(g)+O2(g)═2NO(g)△H=+180.5kJmol﹣1 ,
由①+2×②可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=(﹣1266.8kJmol﹣1)+(+180.5kJmol﹣1)=﹣905.8KJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=﹣905.8KJ/mol.
(1)肼相当于氨气分子中一个氢原子被氨基取代;
该电池正极上 ![]() 得到电子生成
得到电子生成 ![]() ;(2)①根据电荷守恒及c(Cl﹣)=c(NH4+)判断溶液中氢离子浓度和氢氧根离子浓度相对大小,从而确定溶液的酸碱性,得出正确结论;
;(2)①根据电荷守恒及c(Cl﹣)=c(NH4+)判断溶液中氢离子浓度和氢氧根离子浓度相对大小,从而确定溶液的酸碱性,得出正确结论;
②根据电荷守恒及c(Cl﹣)<c(NH4+)判断溶液中氢离子浓度和氢氧根离子浓度相对大小,从而确定溶液的酸碱性,得出正确结论;(3)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,书写平衡常数表达式,分析平衡常数随温度变化,结合平衡移动原理分析反应热量变化情况;②依据浓度商和平衡常数的比较,判断反应进行的方向;(4)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=﹣1266.8kJmol﹣1②N2(g)+O2(g)═2NO(g)△H=+180.5kJmol﹣1 , 利用盖斯定律进行计算,由①+2×②得出正确结论.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】用系统命名法及相关内容填写下列有机物的名称、结构简式及分子式等空白。
(1)  名称:____________。
名称:____________。
(2)写出分子式为C4H8的所有烯烃的结构简式及名称:_____________________。
(3)(CH3)3CC(CH3)2CH(CH3)2名称:______________________。
(4) 名称:___________。分子式:________。
名称:___________。分子式:________。
(5)  名称:________________。
名称:________________。
(6) 的名称是________。
的名称是________。
(7) 名称:_______________________。
名称:_______________________。
(8)3-苯基-1-丙醇的结构简式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学就是在原子、分子水平上研究物质的( )
①组成 ②结构 ③性质 ④转化 ⑤制备 ⑥应用
A.①②③④B.②③④⑤C.③④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示为4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假设碳原子上其余的化学键都与氢原子结合。
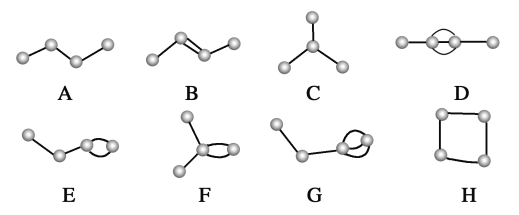
(1)图中属于烷烃的是_____________(填字母,下同)。
(2)在如上图所示的有机化合物中,碳原子与碳原子之间不仅可以形成单键,还可以形成_____________和_____________;不仅可以形成_____________,还可以形成碳环。
(3)含有双键的是_____________,含有三键的是_____________。
(4)图中互为同分异构体的是:A与________;B与________;D与________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分弱酸的电离平衡常数如表所示.下列反应的离子方程式书写错误的是( )
弱酸 | H2SO3 | HClO | H2CO3 |
Ka1 | 1.54×10﹣2 | 2.95×10﹣8 | 4.30×10﹣7 |
Ka2 | 1.02×10﹣7 | ﹣ | 5.61×10﹣11 |
A.NaClO溶液中通入少量CO2:ClO﹣+H2O+CO2═HCO ![]() +HClO
+HClO
B.氯水中加入少量NaCO3粉末:HCO ![]() +H+═H2O+CO2↑
+H+═H2O+CO2↑
C.NaClO溶液中通入少量SO2:2ClO﹣+H2O+SO2═SO ![]() +2HClO
+2HClO
D.Na2CO2溶液中缓慢通入少量SO2:2CO ![]() +H2O+SO2═SO
+H2O+SO2═SO ![]() +2HCO
+2HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题: 
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于(填“晶 体”或“非晶体”).
(2)基态铜原子有个未成对电子,二价铜离子的电子排布式为 , 在CuSO4溶液 中滴入过量氨水,形成配合物的颜色为 .
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2 , 1mol(SCN)2分子中含有.键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是 .
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2﹣的配位数为 .
(5)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为(用含“a、NA 的代数式表示)gcm﹣3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关。下列有关说法不正确的是
A.小苏打可用于治疗胃酸过多
B.还原铁粉可用作食品袋内的抗氧化剂
C.用乙醚从青蒿中提取青蒿素的过程中包含萃取操作
D.墨子号量子卫星使用的太阳能电池,其主要成分为二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰与浓硫酸反应有氧气放出:2MnO2+2H2SO4→2MnSO4+O2+2H2O.下列叙述错误的 是( )
A.浓硫酸作氧化剂
B.硫酸锰是还原产物
C.二氧化锰既是氧化剂又是还原剂
D.氧气是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是用地广泛的香料,合成香豆素的路线如图(其他试剂、产物及反应条件均省略): 
(1)Ⅰ的分子式为;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为;
(2)反应②的反应类型是 , 反应④的反应类型是;
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为;
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能发生银镜反应,也可与碳酸氢钠溶液反应,Ⅴ的结构简式为(任写一种);
(5)一定条件下, ![]() 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com