
| 1 |
| 2 |
| A����H��0 |
| B��Q2��Q1 |
| C����H=2��Q1-Q2�� |
| D����H=Q1-Q2 |
| 1 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A������A����NaAlO2��Һ�е������������� |
| B������B�������ʯ��ˮ��ͨ��CO2������ |
| C������C�����������AlCl3��Һ�е���NaOH��Һ������ |
| D������D�����е����ʵ�����Ca��OH��2��KOH�Ļ����Һ��ͨ��CO2��������ʧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
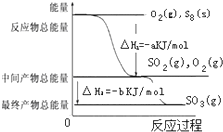 ��һ�������£�S8��s����O2��g��������Ӧ����ת��ΪSO2��g����SO3��g������Ӧ���̺�������ϵ������ͼ��ʾ��ͼ�еġ�H��ʾ����1 mol�����������ݣ�����ͼ�ó��Ľ�����ȷ���ǣ�������
��һ�������£�S8��s����O2��g��������Ӧ����ת��ΪSO2��g����SO3��g������Ӧ���̺�������ϵ������ͼ��ʾ��ͼ�еġ�H��ʾ����1 mol�����������ݣ�����ͼ�ó��Ľ�����ȷ���ǣ�������| A��S8��s����ȼ���ȡ�H=-8akJ?mol-1 |
| B��2SO3��g��?2SO2��g��+O2��g������H=-2b kJ?mol-1 |
| C��S8��s��+8O2��g��=8SO2��g������H=-a kJ?mol-1 |
| D����1molS8��s������SO3��g���ķ�Ӧ�ȡ�H=-��a+b��kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��431kJ?mol-1 |
| B��946kJ?mol-1? |
| C��649kJ?mol-1 |
| D��869kJ?mol-1? |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��v ��NH3��=0.008 mol/��L?s�� |
| B��v ��NO��=0.04 mol/��L?s�� |
| C��v ��O2��=0.006 mol/��L?s�� |
| D��v ��H2O��=0.06 mol/��L��min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��H2O��g��=H2 ��g��+
| ||
| B��2H2 ��g��+O2��g��=2H2O��l����H=-484 kJ�Mmol | ||
C��H2 ��g��+
| ||
| D��2H2 ��g��+O2��g��=2H2O��g����H=+484 kJ�Mmol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����NA�����ӵĶ������� |
| B��0.5 mol���� |
| C����״����5.6 L���� |
| D��9 gˮ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com