
【题目】现有如下微粒:
①I2 ②Br- ③Na+ ④Fe2+ ⑤H+ ⑥Fe3+
⑦Mg ⑧Cl2 ⑨HCl ⑩H2O S SO2
其中在反应中只能作还原剂的有________,只能作氧化剂的有________,既可作氧化剂又可作还原剂的有________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(除标注外,其余每空1分,共7分)X、Y、Z、Q、R、T、U、W分别代表原子序数依次增大的前四周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。W的外围电子排布式为3d63s2。
请回答下列问题:
(1)R基态原子的电子排布式是_________。W在元素周期表的位置是_____________。
(2)XU4的电子式是_____________,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱_____________。
(3)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
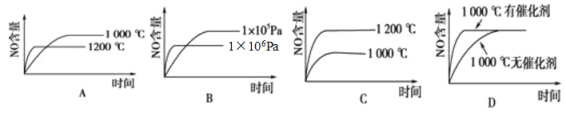
【题目】已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),△H=-1025kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g),△H=-1025kJ·mol-1。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既是离子反应,又是氧化还原反应的是( )
A.2NaOH+H2SO4===Na2SO4+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.BaCl2+H2SO4===BaSO4↓+2HCl
D.H2+CuO===Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g) ![]() 2Z(g)若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达 平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
2Z(g)若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达 平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人体细胞中对生命活动起着重要作用,含量约占细胞鲜重总量97%的化学元素是
A. C、H、O、N、P、Ca B. C、H、O、N、P、K
C. C、H、O、N、S、K D. C、H、O、N、P、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )
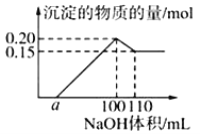
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 molL﹣1
C.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
D.若溶液中仅有两种金属阳离子,且另一种离子为二价阳离子,则a=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
将汽车尾气中含有的CO利用不仅能有效利用资源,还能防治空气污染。工业上常用CO与H2在由Al、Zn、Cu等元素形成的催化剂作用下合成甲醇。
(1)如图是某同学画出CO分子中氧原子的核外电子排布图:![]() ,请判断该排布图 (填“正确”或“错误”),理由是 (若判断正确,该空不用回答)。
,请判断该排布图 (填“正确”或“错误”),理由是 (若判断正确,该空不用回答)。
(2)写出与CO互为等电子体(电子总数相等)的一种分子和一种离子的化学式 。
(3)向CuSO4溶液中加入足量氨水可得到深蓝色[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中 所含配位键是通过配体分子的 给出孤电子对, 接受电子对形成,SO42-的空间构型是 ,该物质中N、O、S三种元素的第一电离能大小顺序为 > > (填元素符号)。
(4)甲醇与乙烷的相对分子质量相近,故二者分子间的作用力(范德华力)相近,但是二者沸点的差距却很大,造成该差异的原因是 ;在甲醇分子中碳原子轨道的杂化类型为 。
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:

① 在该晶胞中,Cu+ 的配位数是 ,
② 若该晶胞的边长为a pm,则Cu2O的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com