
| A、CuSO4溶液加入过量氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| B、碳酸氢铵溶液与过量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O |
| C、稀硫酸中滴加氢氧化钡溶液:H++OH-=H2O |
| D、硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO3-=CO2↑+H2O |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
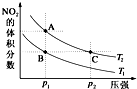 反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法不正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法不正确的是( )| A、B、C两点N2O4的转化率:B=C |
| B、A、C两点气体的颜色:A浅,C深 |
| C、A、C两点N2O4的转化率:A>C |
| D、状态B和状态A,平衡常数:A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| B、铜跟浓硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
| C、铁跟氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
| D、氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3胶体能产生丁达尔现象 |
| B、Fe(OH)3胶体是均一的分散系 |
| C、Fe(OH)3胶体的分散质能透过滤纸 |
| D、Fe(OH)3胶体中分散质粒子的大小在1-100纳米之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前5min内用X的浓度变化表示的平均反应速率为0.5 mol?(L?min)-1 |
| B、5min末时Y的浓度为 2mol?L-1 |
| C、化学方程式中n=3 |
| D、5min末时W的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | E | R | F | |||||
| 三 | A | C | D | H | I | G | ||
| 四 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:
 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com