
【题目】下列气体不能用排水法收集的是
A.O2B.H2C.NH3D.NO
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
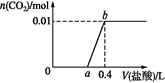
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,常用Fe2(SO4)3溶液作腐蚀液,腐蚀铜质电路板得到废液主要成分是FeSO4和CuSO4,含少量Fe2(SO4)3。某学习小组设计装置从废液中提取铜,如图所示。已知:Fe2+失电子能力比OH- 强。下列说法正确的是

A. 电解初期阴极没有铜析出,原因是2H++2e-=H2↑
B. 石墨极的电极反应式为2H2O+4e-=4H++O2↑
C. 若电路中转移2mol电子,理论上有2molM从交换膜左侧向右侧迁移
D. 若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分浸泡大豆和水稻籽粒,结果大豆种子膨胀的体积比水稻大,原因主要是大豆种子
A.原有的含水量比水稻小
B.种皮具有较强的渗透吸水能力
C.含蛋白质较多,亲水性较强
D.含糖类较多,细胞液浓度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业中废水处理后产生的含重金属污泥废弃物称为电镀污泥,被列入国家危险废物名单中的第十七类危险废物。工业上可利用某电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金金属,其利用回收流程如下:

已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀的pH | 2.1 | 4.7 | 4.3 |
恰好完全沉淀的pH | 3.2 | 6.7 | a |

(1)浸出过程中的生成物主要是Fe2(SO4)3和_______________(填化学式)
(2)除铁等相关操作:
①加入石灰乳调节pH应满足要求是_______________;
②将浊液加热到80℃,趁热过滤。滤渣Ⅱ的主要成分是______________(填化学式)。
(3)还原步骤中生成Cu2O固体的离子反应方程式______________,此步骤中加入NaHSO3的不能过量______________ (离子方程式表达)。
(4)当离子浓度≤1×10-5mol·L-1时认为沉淀完全,则表格中a的值是______________。(已知:T=25℃,Ksp[Cr(OH)3]=6.3×10-31,![]() ,lg2=0.3)
,lg2=0.3)
(5)将铬块加入到稀盐酸或稀硫酸中,可观察到铬逐渐溶解,同时放出氢气。但若将铬块加稀硝酸中,却看不到明显现象。由此推测,出现该现象的可能原因是____________________________。
(6)处理大量低浓度的含铬废水(以CrO42-计)可采用离子交换法,其原理是采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应。一段时间后停lh 通废水,再通NaOH溶液时CrO42-进入溶液回收,并使树脂得到再生。请用离子方程式表示该交换过程____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列分类依据和结论都正确的是
A.明矾、芒硝都是盐,都属于纯净物
B.HNO3、C2H5OH都易溶于水,都是电解质
C.苏打、氢氧化钠溶液均显碱性,都是碱
D.H2SO4、H2SiO3分子中均含有两个氢原子,都是二元强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞的元素和化合物的说法,正确的是
A. Mg是微量元素,是叶绿素的组成成分 B. 土壤和植物根细胞内的元素种类、含量相同
C. 微量元素在细胞中含量很少,可有可无 D. 组成细胞的元素中,C、H、O、N的含量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)的ΔH=__________,有利于提高该反应中CO2平衡转化率的条件是______(填标号)。
CH3OCH3(g)+3H2O(g)的ΔH=__________,有利于提高该反应中CO2平衡转化率的条件是______(填标号)。
A.高温低压 B.高温高压 C.低温低压 D.低温高压
(2)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应: CH3OCH3(g)![]() CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算:0~6.5min内的平均反应速率v(CH3OCH3)=_________,反应达平衡时,二甲醚的分解率为_______,该温度下平衡常数K=__________。
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),要缩短达到平衡的时间,可采取的措施有___________、__________。
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应: CO(g)+CH4(g)![]() CH3CHO(g),反应速率v=v正v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时
CH3CHO(g),反应速率v=v正v逆=k正p(CO)·p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,则CO转化率为20%时![]() =_______。
=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com