
| A、钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量 |
| B、价电子排布为4s24p3的元素位于第四周期第ⅢA族 |
| C、2p和3p轨道形状均为哑铃状,能量也相等 |
| D、在现代化学中,常利用原子光谱上的特征谱线来鉴定元素 |


科目:高中化学 来源: 题型:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 10.4 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 12.4 | 5.2 | 完全溶解:10.8 |
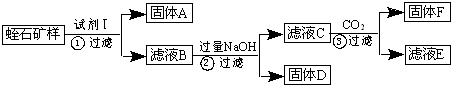
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入0.01 mol?L-1的CH3COOH溶液 |
| B、加入CH3COONa固体 |
| C、稀释 |
| D、加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )| A、正反应是放热反应,m+n>p+q |
| B、逆反应是放热反应,m+n>p+q |
| C、正反应是放热反应,m+n<p+q |
| D、逆反应是放热反应,m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:
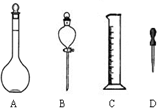 烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:
烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向无色溶液中加入氯化钡溶液有白色沉淀出现,再加入盐酸,沉淀不消失,则溶液中一定含有SO42- |
| B、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中可能含有K+ |
| C、用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,更换烧杯后继续打开分液漏斗活塞,放出上层液体 |
| D、检验某溶液中是否含有Fe2+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=4,R3+是还原产物 |
| B、m=4,R3+是氧化产物 |
| C、2m=y,R3+是还原产物 |
| D、2m=y,R3+是氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com